科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-07-03
来源:中国海洋湖沼学会

 图1 (a)海洋细菌肽酶的体外定向进化过程;(b)野生酶与突变酶的催化动力学参数;(c)野生酶与突变酶对不同有机磷水解活性的比较;(d)有机磷类底物的化学结构
图1 (a)海洋细菌肽酶的体外定向进化过程;(b)野生酶与突变酶的催化动力学参数;(c)野生酶与突变酶对不同有机磷水解活性的比较;(d)有机磷类底物的化学结构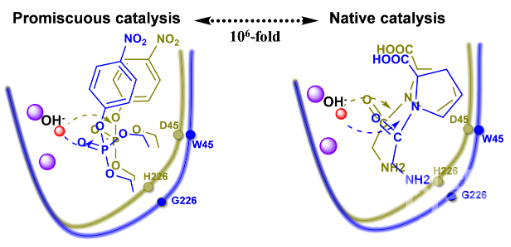 图2 底物选择性转换机制示意图新闻来源:中国科学院南海海洋研究所
图2 底物选择性转换机制示意图新闻来源:中国科学院南海海洋研究所
来源:CSOL1950 中国海洋湖沼学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzI5MzQ3ODA3OA==&mid=2247488939&idx=4&sn=27e88246bc70e66e38d87e2ccdb5f14b&chksm=ec70de7adb07576c9a180988629cb1ea1b83763c5473e87a45929fa3fd54cdee0ba6dffe38da&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
凝血因子或有助于对抗多重耐药的超级细菌

科普 | 纳米纤维素复合材料(上)

Angew:二甘氨酸修饰显著增强抗生素抗菌效果
七叶苷水解试验
精氨酸双水解酶试验
水解纤维素
七叶苷水解试验
青岛能源所揭示洛伐他汀水解酶催化机制
破解NLRP1炎症小体的活化之谜
淀粉水解试验