科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-02
来源:中国病理生理学会
在国家自然科学基金项目(批准号:81925003; 91849105; 81730014; 81900396)等资助下,中国病理生理学会心血管专委会会员,天津医科大学基础医学院艾玎教授、朱毅教授科研团队最新报道了湍流剪切力介导血管内皮功能障碍以及动脉粥样硬化发生的分子机制。研究成果于2020年7月16日在心血管领域专业期刊《Circulation Research》在线发表,题目为“Couplingof integrin α5 to Annexin A2 by flow drives endothelial activation”。链接:https://www.ahajournals.org/doi/abs/10.1161/CIRCRESAHA.120.316857
动脉粥样硬化是一类慢性进行性炎症性疾病,其好发于血管的分叉处及弯曲处,这些部位的血流形式主要是不稳定的湍流,其不规则的血流分布导致血管内皮细胞受到不均一的剪切力,进而激发炎症反应,影响血管的功能,最终导致动脉粥样硬化的发生。因此探索血流剪切力造成血管内皮功能障碍的具体机制以及发现新的治疗靶点已经成为预防和诊疗动脉粥样硬化性疾病的重要手段。然而,湍流是如何引起血管内皮功能障碍的具体机制还不是很清楚。
研究人员前期的实验发现湍流能够促进内皮细胞integrinα5转位入脂筏,导致integrin α5及NLRP3炎性小体的激活,从而介导血管内皮细胞的激活及动脉粥样硬化斑块的形成(Proc Natl Acad Sci U S A. 2016 Jan 19;113(3):769-74)。在本研究中,作者通过脂筏蛋白质组学及结合组学分析发现AnnexinA2是湍流介导integrinα5转位激活的重要靶蛋白;而内皮细胞特异性的敲减AnnexinA2能够明显抑制湍流介导的integrinα5脂筏转位以及内皮细胞的激活;进一步机制研究阐明,湍流通过Piezo1-Ca2+-PTP1B信号级联反应使AnnexinA2酪氨酸24位点去磷酸化,进而导致AnnexinA2构象的变化,增加与integrinα5胞内结构域非保守区的结合;在动物水平,研究人员通过对模型小鼠实施左颈总动脉湍流模型造模以及局部孵育AnnexinA2酪氨酸24位点突变失活的慢病毒实验,进一步证实AnnexinA2对湍流剪切力引起的血管内膜integrinα5的激活,炎症反应以及动脉粥样硬化斑块的形成发挥着重要的作用。MALDI-TOF质谱表明Annexin A2作为酪氨酸磷酸酶PTP1B的底物,当Annexin A2全基因敲除后能够逆转因PTP1B缺失引起的抗动脉粥样硬化效应。
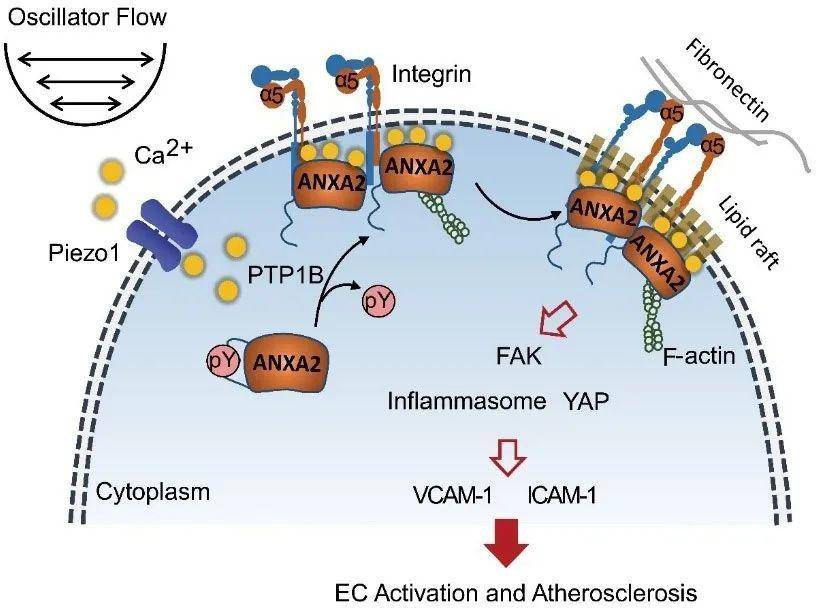 图:湍流通过Piezo1-Ca2+-PTP1B-Annexin A2信号通路介导integrinα5激活及内皮功能障碍 该研究表明Piezo1-Ca2+-PTP1B-AnnexinA2信号通路在局部血流剪切力导致的血管内膜integrinα5脂筏转位以及血管内皮细胞激活中的重要作用,可以作为血流动力学引起的血管内皮功能障碍及动脉粥样硬化新的治疗靶点。
图:湍流通过Piezo1-Ca2+-PTP1B-Annexin A2信号通路介导integrinα5激活及内皮功能障碍 该研究表明Piezo1-Ca2+-PTP1B-AnnexinA2信号通路在局部血流剪切力导致的血管内膜integrinα5脂筏转位以及血管内皮细胞激活中的重要作用,可以作为血流动力学引起的血管内皮功能障碍及动脉粥样硬化新的治疗靶点。来源:gh_cdf22ca96e98 中国病理生理学会
原文链接:https://mp.weixin.qq.com/s?__biz=MzUyNzMwNDY4MQ==&mid=2247484824&idx=1&sn=16ad71be2db6f3c10018e6b4a99a3f9c&chksm=fa00d71ecd775e081aa01778ed16ec97578bced8a93a34214713da151eea1d6e093b397aaf25#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中国病理生理学会招聘公告
中国病理生理学会参加世界公众科学素质促进大会

中国病理生理学会山西临县护工技能提升培训班成功举办
中国病理生理学会秘书处召开党支部会议

中国病理生理学会致全体会员倡议书
2018年中国病理生理学会招聘公告
中国病理生理学会会员撰文分析新冠肺炎病理生理学机制

防范动物源性疾病应警钟长鸣
阻击疫情——中国病理生理学会血管医学专业委员会委员风采
中国病理生理学会新网站上线了!