科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-17
来源:BioArt
责编 | 酶美
选择性寡聚化是自然界中广泛分布的进化规律之一。在亚分子水平,两条、三条或四条α-螺旋链受分子间相互作用的精细调控,平行或反平行排列形成的螺旋卷曲,构成了蛋白质结构的基础单元;在分子团簇水平,多种蛋白质受相互作用界面、结构对称性等因素影响,聚集成同型或异型寡聚化复合物进而发挥生物学功能,例如活细胞中大多数可溶性蛋白和膜蛋白都是具有两个或多个蛋白亚基的寡聚复合物。寡聚化提高了蛋白质的稳定性,增加了局部蛋白质浓度,赋予组装体变构协同性,并在分子识别过程中提供了高特异性。受自然界蛋白质寡聚现象启发,研究团队试图将选择性寡聚效应应用于药物分子的结构设计与优化中,理解药物的寡聚化机理并操纵寡聚结构,以药物团簇作为不可分割的单元靶向受体蛋白并发挥作用。
近日,中国医学科学院基础医学研究所-北京协和医学院王晨轩课题组与国家纳米科学中心方巧君课题组在Science Advances发表了 Molecular recognition of human islet amyloid polypeptide assembly by selective oligomerization of thioflavin T 的论文。该研究在单分子水平揭示了药物分子硫黄素T以寡聚态与靶点胰淀素蛋白结合,并从能量角度阐明分子识别过程中硫黄素T分子选择性寡聚化的微观机制。

为揭示药物分子的寡聚化及分子识别机制,研究团队以β-淀粉样蛋白特异性标记分子硫黄素T(ThT)作为研究对象,利用具有超高实空间分辨能力的扫描隧道显微技术(STM)在单分子水平研究ThT在其受体人胰岛淀粉样蛋白关键8-37片段(hIAPP8-37)上的吸附结构。研究团队发现ThT在受体蛋白表面上的结合结构以四种寡聚态存在:二聚体(头/尾相接“2×1”)、二聚体(肩并肩相接“1×2”)、四聚体(“2×2”方式)、六聚体(“2×3”方式)。寡聚态具有奇偶数选择性,即仅发现二、四、六偶数寡聚状态。四种寡聚态在自由能上表现出非简并性,其中“2×2”四聚体的布居分布概率最高,即能量最优。吸附的药物分子寡聚态由(1)药物分子之间的内聚功与(2)药物-蛋白间的黏附能共同决定。依据概率分布与相对能量差理论可计算出两个头/尾相接的ThT分子间内聚功为6.4 kBT,强于两个肩并肩相连ThT的分子间内聚功(4.2 kBT)。而ThT与受体蛋白之间的黏附能依赖于结合位点的微环境。该工作将STM单分子成像与界面物理化学理论相结合,为研发选择性寡聚化药物分子奠定了理论基础。
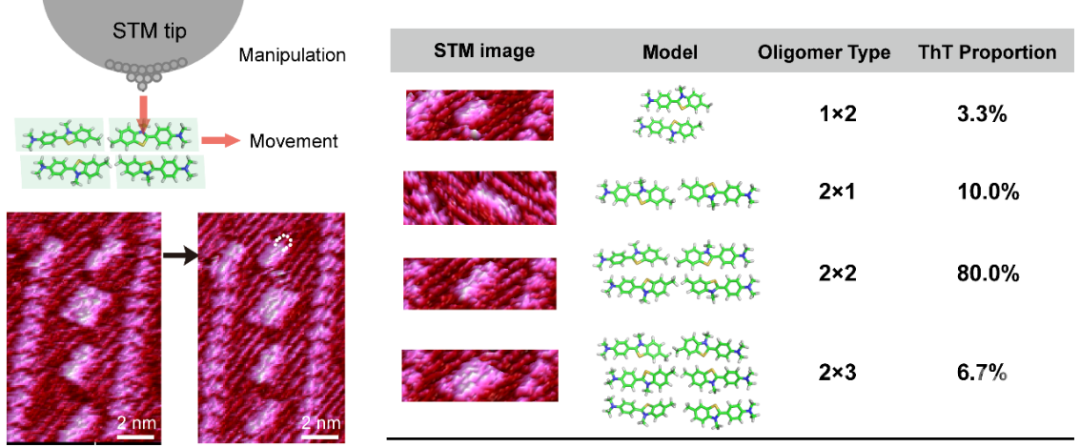 图1. 单分子成像揭示ThT在hIAPP8-37蛋白表面以4种寡聚态存且表现出选择性
图1. 单分子成像揭示ThT在hIAPP8-37蛋白表面以4种寡聚态存且表现出选择性该研究由北京协和医学院基础医学研究所-医学分子生物学国家重点实验室王晨轩团队与国家纳米科学中心方巧君团队、王琛-杨延莲团队完成。基础医学研究所和重点实验室于兰兰博士为本文的第一作者,方巧君、王晨轩为通讯作者。基础医学研究所许海燕教授、俄亥俄州立大学王晓光教授、华东理工大学王宜冰教授参与了该项研究。
论文链接:https://advances.sciencemag.org/content/6/32/eabc1449来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652496151&idx=5&sn=e478aac04a048968985484fa62542593&chksm=84e272a3b395fbb5200800811b52f6b42f0bdef2bb16c382a1032e742d9bf8b8fa7a9a9465fa#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
上海科技大学白芳团队开发小分子药物阻断新冠病毒刺突蛋白构象转变

Angew. Chem.:蛋白-蛋白以及蛋白-核酸大分子复合体的光控化学交联

王晨轩团队揭示药物分子硫黄素T以选择性寡聚态结合靶点胰淀素蛋白的微观机制

新型小分子药物可长效作用于HIV蛋白衣壳
研究显示新型自动给药胶囊可增强大分子蛋白质药物吸收
【大师讲堂】“单分子下拉”——以单分子分辨率解析蛋白“身份”
【微健康】啥都能网购的时代,这个可不能网上随便买

关于组织召开“第八届全国治疗药物监测学术年会” 的通知 (第二轮)
为什么药片有那么多不同的颜色?竟是因为…
【大师讲堂】以单分子荧光确定蛋白“身份”