科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-19
来源:中国生物物理学会
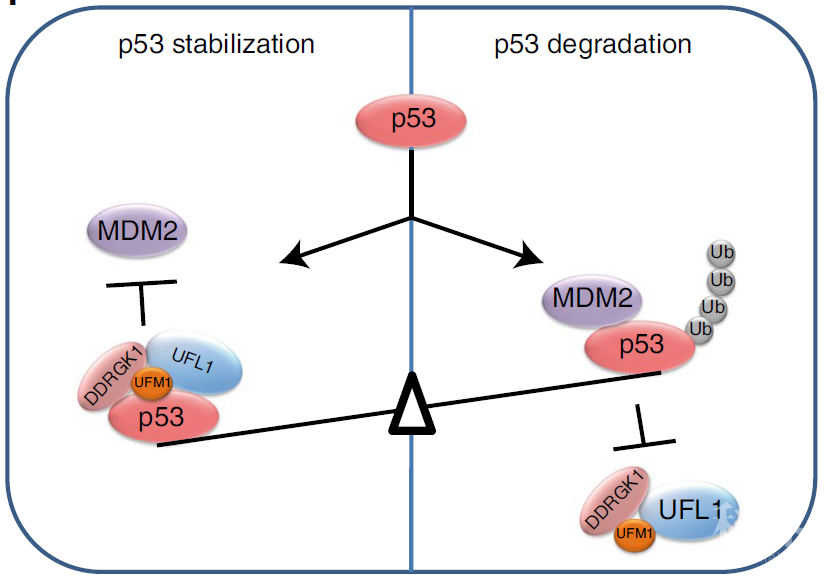
蛋白质翻译后修饰在生命活动中发挥着重要作用,蛋白修饰异常与诸多人类重大疾病密切相关。第一个被鉴定的蛋白质修饰系统是泛素化修饰,以共价键的形式将泛素分子结合到靶蛋白的赖氨酸残基上。目前已经发现了十几种类泛素蛋白质,它们利用相似的酶促反应修饰靶蛋白。这些类泛素化修饰包括SUMO、NEDD8、UCRP/ISG15、Atg8、Atg12、FAT10、UFM1等【1】。 图1. UFM1修饰系统示意图
图1. UFM1修饰系统示意图
参考文献
向上滑动阅览
[1] van der Veen AG, Ploegh HL. Ubiquitin-like proteins. Annu Rev Biochem. 2012; 81: 323–357.
[2] Komatsu M, Chiba T, Tatsumi K, et al. A novel protein-conjugating system for Ufm1, a ubiquitin-fold modifier. EMBO J, 2004, 23, 1977-86.
[3] Tatsumi K, Sou YS, Tada N, et al. A novel type of E3 ligase for the Ufm1 cojugation system. J Biol Chem 2010;285:5417-27.
[4] Yannis Gerakis, Michaela Quintero, Honglin Li, and Claudio Hetz. The UFMylation System in Proteostasis and Beyond. Trends in Cell Biology, December 2019, 29: 12
[5] Yoo HM, Kang SH, Kim JY, et al. Modification of ASC1 by UFM1 is crucial for ERalpha
transactivation and breast cancer development. Mol Cell, 2014;56:261-74.
[6] Bo Qin, Jia Yu, Somaira Nowsheen, et al. UFL1 promotes histone H4 ufmylation and ATM activation. Nat Commun, 2019, 10, 1242
[7] Zhifeng Wang, Yamin Gong, Bin Peng, et al. MRE11 UFMylation promotes ATM activation. Nucleic Acids Res, 2019, 47, 4124-4135
[8] Kruse JP, Gu W. Modes of p53 Regulation. Cell 2009, 137 (5):609-622
[9] Lee JT, Gu W. The multiple levels of regulation by p53 ubiquitination. Cell Death Differ, 2009, 10.1038
[10] Grossman SR, Deato ME, Brignone C, Chan HM, Kung AL, Tagami H, Nakatani Y, Livingston DM. Polyubiquitination of p53 by a ubiquitin ligase activity of p300. Science, 2003, 300:342-344.
本文转载自公众号“BioArt”(BioGossip)
中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979

来源:BSC-1979 中国生物物理学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NjE1NTQ5Mg==&mid=2649502135&idx=1&sn=5e1de87fefc1cec23bb68f63f8cf0de2&chksm=87d5983cb0a2112a7d17dd499e9a661eab63b06a7d57642abeb8db2c3562dd022f5bc213431a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

大会专辑|中国生物物理学会代谢组学分会正式成立

【通知】中国生物物理学会网站暂停开放通知

会议报道|低氧与健康科学大会,西藏鲁郎

中国生物物理学会2019年会讯!

中国生物物理学会2019年会讯(全)

中国生物物理学会祝全体会员中秋快乐!

中国生物物理学会祝您元旦快乐!

【致敬科研巾帼】中国生物物理学会祝您节日快乐!

【学会动态】中国生物物理学会太赫兹生物物理分会成立

中国生物物理学会给您拜年啦!