科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-08-22
来源:Bio生物世界
过去研究表明,启动Th17细胞分化,需要至少两个细胞因子:白细胞介素6(interleukin-6, IL-6)和转化生长因子-β(transforminggrowth factor-β, TGF-β),它们的共同作用能诱导Th17首要转录因子RORγt的稳定高表达,从而打开Th17细胞分化的大门,但其中的分子机理尚缺乏了解。
顺式调控元件(Cis-regulatory elements,其中包括保守非编码序列)能通过与转录因子、表观调控因子等相互作用,在T细胞分化和命运控制中扮演重要角色。但此前关于辅助性T细胞亚群的相关研究主要集中在细胞因子的顺式调控机制方面,譬如董晨团队曾在2007年首先开启Th17表观和顺式调控机制研究(J Biol Chem 282:5969-72),并在2012年发现了调控Il17表达和Th17细胞分化的关键增强子序列CNS2 (Immunity,236:23-31)。
2020年8月21日,清华大学免疫学研究所董晨院士团队在 Immunity 杂志上发表题为:The conserved non-coding sequences CNS6 and CNS9 controlcytokine-induced Rorc transcription during T helper 17 celldifferentiation 的研究论文。
该研究发现起始Th17细胞分化所必需的两个细胞因子IL-6和TGF-β,通过与Rorc基因位点两个不同的保守非编码DNA序列(conserved non-coding sequence, CNS)相互作用,协同调控RORγt的表达及Th17细胞分化。

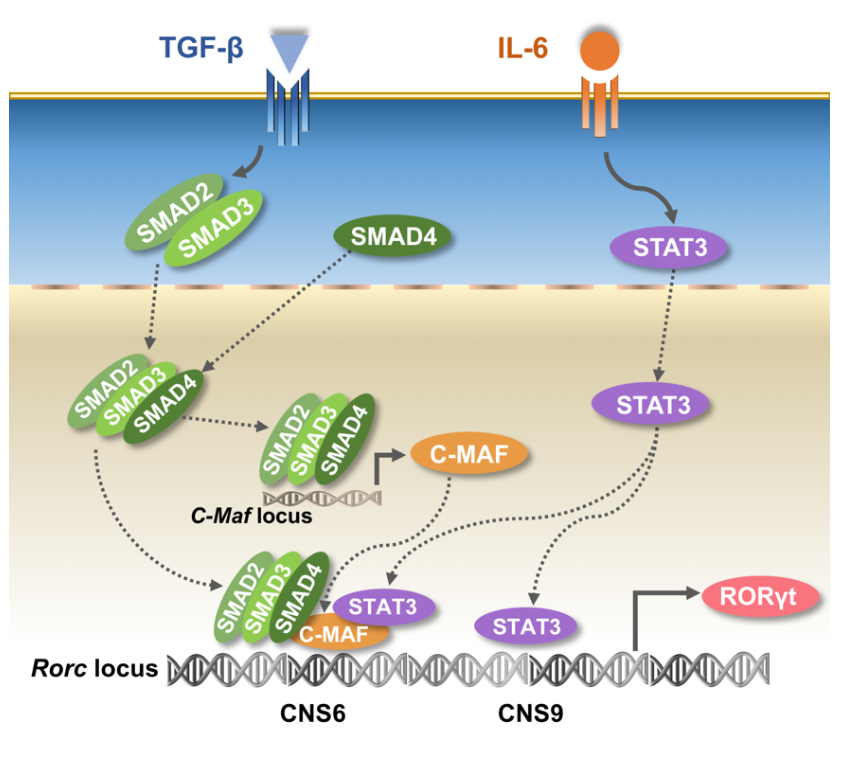 CNS6和CNS9介导Th17细胞中IL-6和TGF-β信号诱导的RORγt表达
CNS6和CNS9介导Th17细胞中IL-6和TGF-β信号诱导的RORγt表达来源:ibioworld Bio生物世界
原文链接:https://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247506951&idx=4&sn=0e418219122bdeb0d05285afe2295462&chksm=fbf628d2cc81a1c4185ae70c49febdc380f34fd627d8e00e159c4c7e8a3e0bd627e01c555f49#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

研究揭示调控iNKT细胞分化终末成熟的分子机制

Cell:来源于Th17的组织驻留记忆性T细胞在对抗细菌感染中起决定性作用
Immunity :董晨团队揭示发烧影响Th17细胞分化和自身免疫疾病
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结
关于举办“环境友好的农林害虫生态调控与生物防治技术高级研修班”通知

TGF-β促进Th17细胞产生IL-22,从而促进肠道相关肿瘤的发生
Molecular Plant 出版“植物激素”专辑

研究揭示乙烯调控拟南芥根毛细胞分化的分子机制
Cell | 发现新型致病性Th17细胞诱导蛋白

重大进展!陆军军医大学吴玉章/倪兵发现Th17细胞分化激活的新机制