科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-03-29
蛋白成核过程在生理、病理和生物纳米技术方面具有重要意义【1】。特别是,通过受控的成核和聚集过程,细胞利用蛋白分子成核剂可构建相应的细胞结构或纤维网络,完成相应的生理功能。其中一个例子是定位在大肠杆菌细胞膜上的淀粉样蛋白特异性基因B(CsgB)蛋白,这种蛋白能作为成核中心,引导主要蛋白质亚基CsgA在细胞表面和胞外形成卷曲纤维网络,最后促进大肠杆菌生物被膜的形成【2】。另一例子是肌动蛋白相关蛋白复合物(ARP2/3),作为成核促进因子和前体蛋白,它们精确控制活细胞中肌动蛋白细胞骨架的形成【3】。以curli纤维为例,尽管已有诸多文献描述生物被膜中CsgB作为成核蛋白在CsgA纤维生长过程中扮演十分关键的作用,但是由于寡聚体形成过程的随机性以及快速性,当前的研究并不能直接观测CsgB促进CsgA形成寡聚体、甚至纤维的过程。因此,成核蛋白如何在单分子水平上调控纤维的自组装以及更深层次的机制仍然是领域里的不解之谜。
2019年3月27日,上海科技大学物质学院钟超课题组联合上海交通大学樊春海教授课题组发展了通过DNA纳米折纸技术调控淀粉样蛋白的自组装行为的新方法,并在机理研究方面取得重要进展。该项成果以Directing Curli Polymerization with DNA Origami Nucleators为题在Nature Communications上在线发表。

在这项研究中,科研人员首先设计并构建形状稳定、结构对称的三角形DNA折纸,并将成核蛋白修饰在该DNA折纸的顶端,得到DNA折纸/成核蛋白复合结构。通过将该复合物与CsgA单体共同孵育,从而使得CsgA单体在成核蛋白诱导作用下,优先在DNA折纸的顶端自组装成单条蛋白纤维。利用原子力显微镜(AFM)和硫磺素(ThT)荧光检测法,并通过对比在有无成核蛋白的条件下纳米纤维的自组装动力学,研究人员证明DNA折纸上的成核中心会引发并促进CsgA单体在成核位点优先形成蛋白纤维。值得一提的是,本研究利用高速原子力显微镜(HS-AFM)首次清晰地观测到CsgA单体在成核蛋白作用下的自组装过程。此外,科研人员还观察到一个有趣的现象:原纤维可以分别以远离(离开模式)或走向成核剂(到达模式)的方式加速生长。为此研究人员提出成核蛋白可能在大肠杆菌生物被膜的形成过程可能起着两种不同但互补的作用:即作为成核位点或作为捕获附近生长的纳米纤维的捕获位点同时促进纤维网络的快速生成。
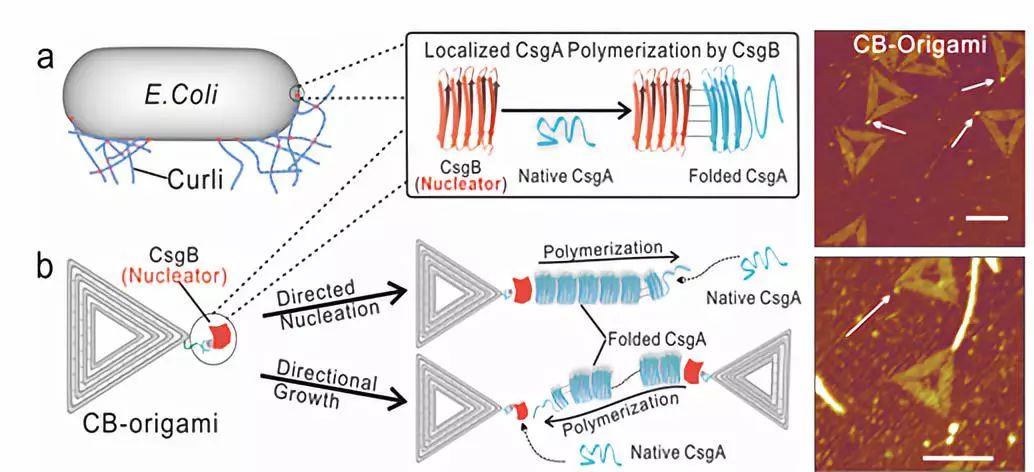
图1. 在修饰了成核蛋白CsgB的DNA折纸结构的引导下,大肠杆菌生物被膜淀粉样蛋白CsgA能够定点加速聚合;AFM高度图显示纤维从CsgB-DNA复合物顶点开始生长。白色箭头表示在顶点形成的点状寡聚物。标尺:100 nm。
DNA折纸作为一种分子标记,可以精确定位单个成核蛋白的位置,因此,该项技术甚至可以从集成测量中检查和区分独立的随机成核事件。从本质上说,这项技术排除了分子自聚合可能造成的干扰,为研究蛋白分子在成核蛋白作用下最初的分子成核事件提供了一种有用的、可推广的方法。例如,这一技术可以用于研究生物学中与神经退行性疾病相关的淀粉样蛋白或者其他功能性淀粉样蛋白在分子尺度的成核和生长机制。最后,因为这种修饰了成核蛋白的DNA纳米结构能原位定向地引发淀粉样蛋白纤维的自组装,因此这一技术也为构建新型的DNA 折纸/功能性淀粉样蛋白的复合纳米结构提供了一种新的思路和方法。鉴于DNA折纸和淀粉样蛋白材料在纳米技术中有着广泛的应用,同时这些复合结构结合了DNA折纸结构可编程特性和功能淀粉样蛋白的功能可调性,因此,这种通过成核蛋白诱导的复合结构在生物纳米技术领域有着潜在的应用价值。
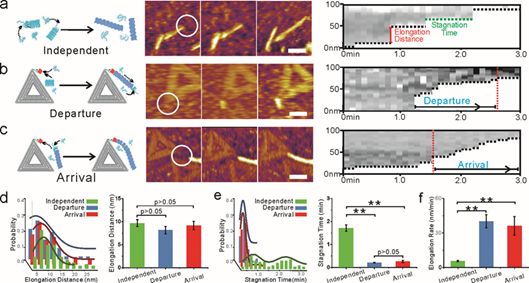
图2. 利用高速原子力显微镜(HS-AFM)原位探测CsgB-DNA折纸复合结构引导CsgA聚合的过程:(a)无CsgB-DNA折纸 (独立模式);(b,c)有CsgB-DNA折纸(b,c)时CsgA纤维形成示意图以及相应的AFM高度图与形成CsgA纤维长度变换图: (d-f)比较在独立、出发和到达三种不同生长模式下,纤维每步生长所需的平均停滞时间和延伸速率。标尺: 50 nm。
据悉,该论文第一作者毛秀海是钟超和樊春海教授联合指导的博士后(现任职上海交通大学分子医学研究院),物质学院的博士研究生李柯(第二作者)在研究过程中也做出了重要的贡献;通讯作者是上海科技大学材料和物理生物中心的钟超教授和上海交通大学的樊春海教授。
原文链接:
https://www.nature.com/articles/s41467-019-09369-6
参考文献
1. Qiang, W., Yau, W. M., Lu, J. X., Collinge, J. &Tycko, R. Structural variation in amyloid-beta fibrils from Alzheimer’s diseaseclinical subtypes. Nature 541, 217–222 (2017).
2. Kollman, J. M. et al. Ring closure activates yeast gammaTuRC for speciesspecific microtubule nucleation. Nat. Struct. Mol. Biol. 22,132–137 (2015).
3. Pollard, T. D. Regulation of actin filament assembly byArp2/3 complex and formins. Annu. Rev. Biophys. Biomol. Struct. 36, 451–477 (2007).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468166&idx=8&sn=577efbb687235b9dcf65a725ed3f53db&chksm=84e2e072b3956964babb639216cde736b045e0f680ad4b18f23f7c9656f5e58d78fbc65ab965&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

运用数学思想进行折纸设计
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结

折纸的STEM教育价值

(3)折纸与数学:你所不知道的现代折纸

中国药科大学钟文英团队《AFM》:三酶调控的超分子水凝胶用于氯尼达明的无载体递送
可调控物性和构造新器件的“石墨烯折纸术”

3D折纸叠出大脑

纳米薄膜的智能卷曲折纸

中国科学家首揭灵长类动物发育和寿命调控的关键通路

折纸与数学:你所不知道的现代折纸