科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-12
来源:BioArt
原标题:Cell | 脑洞大开,脑成像深度提高至1.22mm,双光子、三光子显微镜连体新技术
快速发展的光学显微镜成像技术以更快捷、更高分辨率、更深脑区对神经元群体或个体实现功能和结构上成像。通过解读这些神经群体或个体的“身份秘密”,也极大地促进了神经科学的重大发现。目前已经广泛使用双光子显微镜结合钙离子指示剂实现活体观察神经元活动,但是无法完成快速捕捉更多神经元群活动。
2014年奥地利维也纳大学Alipasha Vaziri教授(现在已经在美国纽约洛克菲勒大学工作)开发出一种被称为光场反褶积显微镜的技术绘制整个线虫并利用一种算法提供高分辨率的三维图像来分析它们的结构特征【1】。当时他们畅想着通过改善该技术的速率和分辨率获得对更大组织——哺乳动物大脑的功能成像,如今他们做到了。
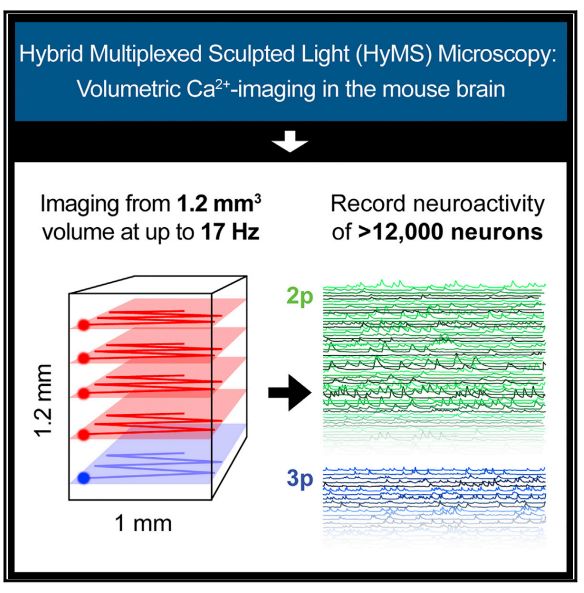
2019年4月11日,美国纽约洛克菲勒大学Alipasha Vaziri课题组采用容积成像技术结合双光子、三光子显微镜技术开发HyMS技术(hybrid multiplexed sculpted light microscopy)可快速对钙信号进行三维成像【2】,使用该技术可实现在单细胞水平上记录12000个以上神经元的钙信号、以17Hz的频率进行1.2mm3的三维成像,该研究以Volumetric Ca2+ Imaging in the Mouse Brain Using Hybrid Multiplexed Sculpted Light Microscopy为标题,发表在了Cell上。
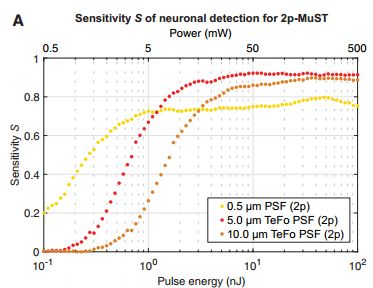
研究人员认为这种成像技术应该满足四个要求,第一能够满足捕捉到钙离子瞬时变化的时间维度(毫秒级别);第二,保证激光对组织无损伤;第三,能够准确提取单个神经元活动信息,达到单细胞分辨率;第四,能够快速实现三维成像。为达到这些要求,研究人员将衍射极限(diffraction-limited spot)设为0.5,5,10um共三个数值(图1),结果发现将衍射极限光斑定为5微米时,即使在较低的激光功率下灵敏度可达90(灵敏度反映去除背景影响后能够真正检测神经元信号的真实阳性率)。此外,该系统在双光子显微镜搭载单脉冲全自动激发和同步检测,快速远程扫描(加快轴向扫描速度)等模块,名为2P-MuST(Multiplexed Scanned Temporal Focusing),能够带来快速的容积成像。

图1, 2P-MuST灵敏度在不同衍射极限值下随着激光功率变化而变化
研究人员利用2P-MuST技术对小鼠后顶叶皮层(该区域比较方便成像)进行快速在体钙成像,成像区域体积为690*675*600 um ,能够同时捕获同时发生的大约3000-5000神经元的活动。为验证2P-MuST技术的适用性,研究人员将成像区域定位在初级听觉皮层。在声音刺激下听觉皮层激活的神经元与这种刺激具有很高的相关性,但是由于邻近的神经元也会对类似频率的声音产生响应,因此也会被激活。为解决这一问题,研究人员利用在 MuST捕捉声音刺激下听觉皮层神经元活动.在20分钟内记录到11097个激活的神经元活动,经过算法分析其中2743个神经元与声音刺激高度相关(图2),从而解决了上述问题。
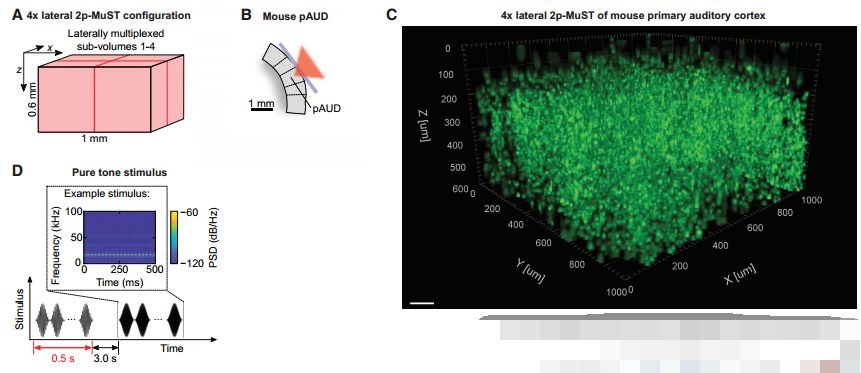
图2 小鼠听觉皮层进行快速活体钙成像
由于双光子显微镜活体成像可探测到的深度极限为800微米,无法看到更深的脑区【3】。因此,研究人员在三光子显微镜上的基础上开发OPCPA(optical parametric chirped pulse amplifier)技术(3p OPCPA),将其成像深度提高至1.22mm,可实现整个皮层和海马CA1区钙成像。
看了半天,可能很多读者会认为这不就是在双光子和三光子显微镜上分别加了很多模块,实现快速容积成像吗?其实并不是这么简单,其中一些模块是研究人员经过多次反复试验摸索出的,之前是没有人做出来的。当然研究人员并不止于此,他们将双光子和三光子显微镜结合在一起,称为HyMS microscopy,这才是重点之重。HyMS 显微能够完全实现2P-MuST和3P-OPCPA的成像功能。同时实现跨区域成像(图3)。
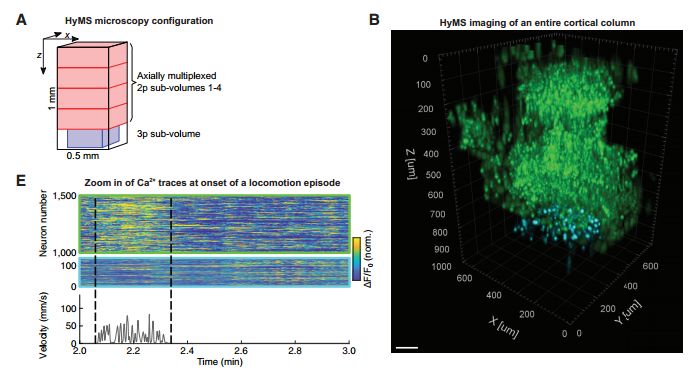
图3 HyMS技术捕获整个皮层(深度)神经元活动
总的来说,HyMS技术实现在体皮层、海马脑区跨区域、快速容积成像,为研究皮层和海马之间的信息交流以及相关的行为提供了技术支持。
参考文献
1.Prevedel, Robert , et al. Simultaneous whole-animal 3D imaging of neuronal activity using light-field microscopy. Nature Methods 11.7(2014):727-730.
2.Siegfried Weisenburger,Frank Tejera,Volumetric Ca2+ Imaging in the MouseBrain Using Hybrid Multiplexed Sculpted Light Microscopy. Cell,177, 1–17
3.Tao, X., Lu, J., Lam, T., Rodriguez, R., Zuo, Y., and Kubby, J. (2017). A threephoton microscope with adaptive optics for deep-tissue in vivo structural and functional brain imaging. Proc. SPIE. Published online February 8, 2017
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468563&idx=2&sn=c5277f4a405dd1fac3029302ff5f85ff&chksm=84e2e6e7b3956ff1807d32ca254668a4fef3a8fc17686548482134663a2cd2a517ccf7d7115d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
北大教授研发出超灵敏结构光超高分辨率显微镜

CICC科普栏目|当人体器官用显微镜来观察时,保证你会重新认识了自己
新一代微型化双光子荧光显微镜研制成功
角膜显微镜

程和平院士:2.2克微型双光子显微镜及其在脑科学中的应用

《Cell》神经元诱导干细胞重生

首款可探测紫外自体荧光团的新型双光子显微镜

中国科学院深圳先进技术研究院研发可探测紫外自体荧光团的双光子显微镜
北京大学第二代微型化双光子显微镜问世

Cell:星形胶质细胞保护神经元免受毒素累积