科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-19
来源:BioArt
撰文 | 陶晓花
蛋白酶体是高度保守的多蛋白复合物(包含47个亚基,形成桶状结构),可降解受损和错误折叠的蛋白质【1】。蛋白酶体亚基基因的表达受应激反应bZIP转录因子的Nrf / NFE2家族成员Nrf1 / NFE2L1的调节。Nrf1与Nrf2 / NFE2L2密切相关,二者都与相同的DNA基序结合,但具有不同的功能。Nrf1在蛋白酶体功能障碍期间介导蛋白酶体亚基基因的代偿性上调,而Nrf2调节外源物解毒和氧化应激反应【2,3】。在秀丽隐杆线虫(Caenorhabditis elegans)中,Nrf同源物skn-1行使与Nrf1/2相似的功能【4】,skn-1/Nrf通过选择性剪接和转录起始位点产生三种蛋白质同种型:SKN-1A、SKN-1B和SKN-1C。所有三种SKN-1亚型共享相同的C末端CnC DNA(Cap ‘‘n’’ Collar)结合结构域,但具有不同的N末端和表达模式【5】。SKN-1A含有N末端跨膜结构域(独有),使其定位于内质网(endoplasmic reticulum, ER)【6】,并在所有组织中表达;SKN-1B在感觉神经元中表达;SKN-1C仅在肠中表达【4,7】。
为了调节蛋白酶体亚基基因,ER中N-糖基化的SKN-1A/Nrf1依赖ERAD逆向转运至细胞质后,经PNG-1/NGLY1(PNGase)去糖基化,并通过DDI-1/DDI2天冬氨酸蛋白酶进行蛋白水解形成成熟SKN-1A,随后被降解【8】。如果蛋白酶体功能受损,一些SKN-1A/Nrf1逃脱降解而进入细胞核,使蛋白酶体亚基的基因表达上调【9】。但是目前以去糖基化和蛋白酶水解过程活化SKN-1A/Nrf1的分子机制尚不清楚。
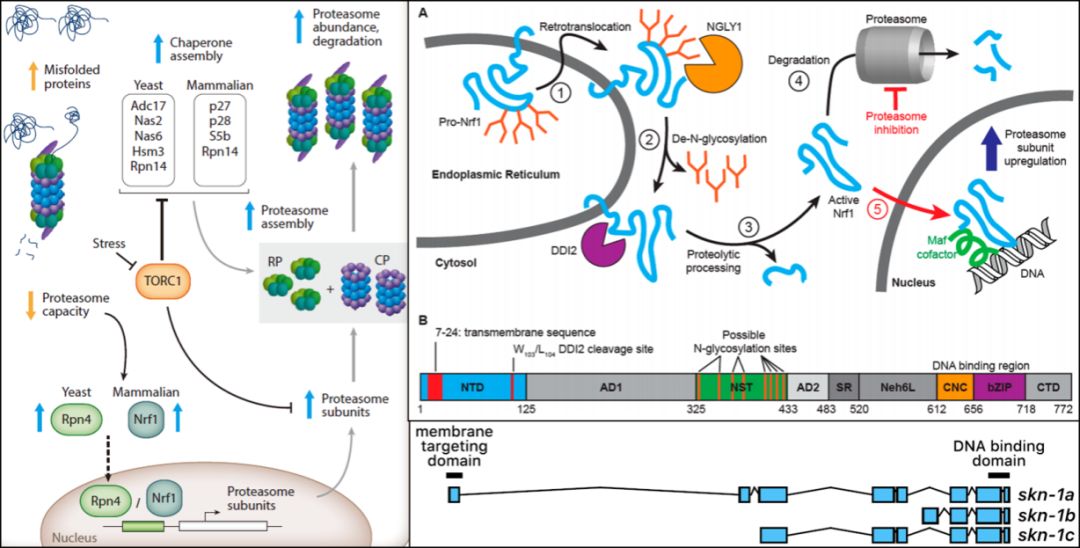
哺乳动物细胞通过在ER中积累Nrf1来响应蛋白酶体功能障碍(DOI: 10.1146/annurev-cellbio-111315-125334);Nrf1的激活途径和功能结构域(DOI: 10.1021/acscentsci.7b00224);SKN-1同种型图(DOI: 10.1016/j.freeradbiomed.2015.06.008)
2019年4月18日,美国马萨诸塞州总医院的学者在Cell上发文Protein Sequence Editing of SKN-1A/Nrf1 by Peptide:N-Glycanase Controls Proteasome Gene Expression,以线虫为研究对象,建立了PNG-1 PNGase和DDI-1天冬氨酸蛋白酶激活SKN-1A的分子机制。本文发现SKN-1A的功能化需要糖基化、去糖基化和蛋白水解作用,并在去糖基化时进行蛋白序列编辑从而将N-糖基化天冬酰胺残基转化为天冬氨酸,随后成熟的SKN-1A会激活蛋白酶体亚基的基因表达,从而增强细胞中的蛋白质稳态。此结果揭示了维持蛋白酶体稳态的分子机制,并为蛋白酶体活性的靶向调控铺平了道路。

研究人员通过序列比较和突变分析鉴定了SKN-1A的蛋白质序列中四个保守的天冬酰胺糖基化位点(N325,N338,N370和N403),这些位点通过PNGase的脱酰胺作用去糖基化形成天冬氨酸,从而完成对蛋白SKN-1A的序列编辑。这说明蛋白酶体亚基基因的调节需要氨基酸序列的精确变化。PNGase是糖基化依赖性肽序列编辑酶,其在整个真核生物中高度保守,SKN-1A是目前发现的第一个依赖于该脱酰胺反应并能正常行驶功能的内源蛋白。这一发现提示某些蛋白质可能也需要借助PNGase依赖性蛋白酶的N-糖基化天冬酰胺残基的编辑功能来完成下游调控。
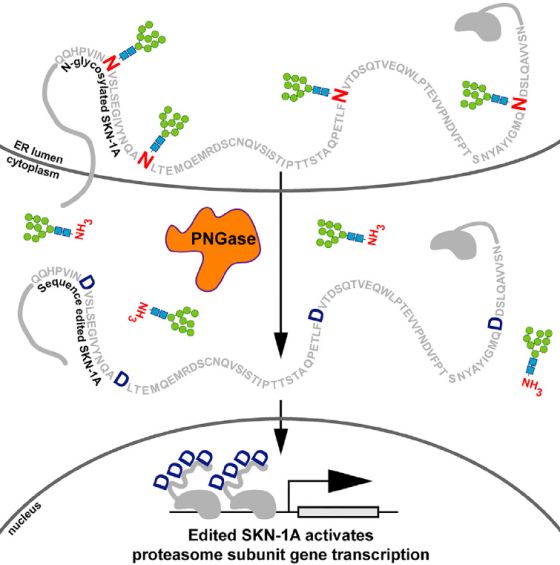
依赖于N-糖基化天冬酰胺残基的去糖基化的翻译后蛋白质序列编辑调节秀丽隐杆线虫中的蛋白酶体功能。
该研究揭示SKN-1A和SKN-1C虽然均由skn-1基因编码,但两转录因子功能不同:SKN-1A响应蛋白酶体功能障碍而SKN-1C响应氧化应激,这分别对应哺乳动物细胞的Nrf1和Nrf2。有趣的是,WDR-23/WDR23特异性抑制C. elegans中的SKN-1C和人类中的Nrf2【10】。这表明动物细胞可部署不同的SKN-1/Nrf以对抗不同的蛋白质毒性。
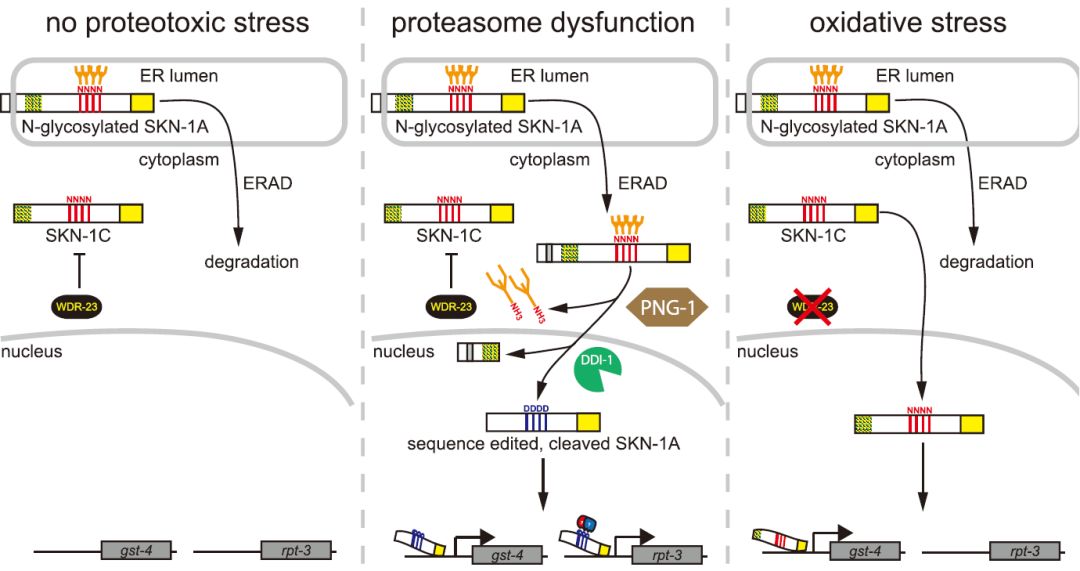
SKN-1A和SKN-1C对不同应激反应的基因表达调控
蛋白酶体功能缺陷可能会导致成人的神经退行性疾病,并且可能是衰老过程中细胞和器官功能下降的一般性特征【11】。本文发现增强SKN-1A/Nrf1活性可增强蛋白酶体功能并对人β-淀粉样蛋白表现出抗性,这些结果表明通过Nrf1增强蛋白酶体水平可以增强蛋白质稳态,这可能为治疗神经退行性疾病提供新的见解。同时研究人员还发现SKN-1A可延长寿命(数据未发表),由于氧化应激障碍(SKN-1C / Nrf2降低)和蛋白酶体功能受损(由SKN-1A / Nrf1补偿)都可能导致衰老,因此明确各种长寿干预措施对每种SKN的依赖程度至关重要。
原文链接:
https://doi.org/10.1016/j.cell.2019.03.035
制版人:半夏
参考文献
1. Collins, G.A., and Goldberg, A.L. (2017). The Logic of the 26S Proteasome. Cell 169, 792–806.
2. Ma, Q. (2013). Role of nrf2 in oxidative stress and toxicity. Annu. Rev. Pharmacol. Toxicol. 53, 401–426.
3. Radhakrishnan, S.K., Lee, C.S., Young, P., Beskow, A., Chan, J.Y., and Deshaies, R.J. (2010). Transcription factor Nrf1 mediates the proteasome recovery pathway after proteasome inhibition in mammalian cells. Mol. Cell 38, 17–28.
4. An, J.H., and Blackwell, T.K. (2003). SKN-1 links C. elegans mesendodermal specification to a conserved oxidative stress response. Genes Dev. 17, 1882–1893.
5. Blackwell, T.K., Steinbaugh, M.J., Hourihan, J.M., Ewald, C.Y., and Isik, M. (2015). SKN-1/Nrf, stress responses, and aging in Caenorhabditis elegans. Free Radic. Biol. Med. 88 (Pt B), 290–301.
6. Glover-Cutter, K.M., Lin, S., and Blackwell, T.K. (2013). Integration of the unfolded protein and oxidative stress responses through SKN-1/Nrf. PLoS Genet. 9, e1003701.
7. Bishop, N.A., and Guarente, L. (2007). Two neurons mediate diet-restrictioninduced longevity in C. elegans. Nature 447, 545–549.
8. Tomlin, F.M., Gerling-Driessen, U.I.M., Liu, Y.-C., Flynn, R.A., Vangala, J.R., Lentz, C.S., Clauder-Muenster, S., Jakob, P., Mueller, W.F., Ordon˜ ez-Rueda, D., et al. (2017).Inhibition of NGLY1 Inactivates the Transcription Factor Nrf1 and Potentiates Proteasome Inhibitor Cytotoxicity. ACS Cent. Sci. 3, 1143–1155.
9. Lehrbach, N.J., and Ruvkun, G. (2016). Proteasome dysfunction triggers activation of SKN-1A/Nrf1 by the aspartic proteaseDDI-1. eLife 5, e08153.
10. Lo, J.Y., Spatola, B.N., and Curran, S.P. (2017). WDR23 regulates NRF2 independently of KEAP1. PLoS Genet. 13, e1006762.
11. Pilla, E., Schneider, K., and Bertolotti, A. (2017). Coping with Protein Quality Control Failure. Annu. Rev. Cell Dev. Biol. 33, 439–465.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652468952&idx=4&sn=18ee40bc1a18abde9fb3200bf0e80f40&chksm=84e2e56cb3956c7a1f6fe1a5349d6921c6e11ad745f1cd1c306eadf9412258f8e3a96cb802e2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Science:泛素蛋白酶体途径介导microRNA降解

Dev Cell : 刘凯博士等阐明蛋白酶体转运的分子机理和生理意义
蛋白酶体

【学会动态】第三届泛素-蛋白酶体与细胞稳态调控研讨会在南方科技大学召开
合作揭示哺乳动物PA28αβ-iCP免疫蛋白酶体的结构及激活机制
环境友好的农林害虫生态调控与生物防治技术——2017高级研修班总结
Nature Commun:轻度的蛋白酶体胁迫能够提高拟南芥叶绿体的光合性能

欧阳松应/朱平课题组合作揭示PA200激活蛋白酶体分子机制

中国科学家首揭灵长类动物发育和寿命调控的关键通路

【会议通知】第三届泛素-蛋白酶体与细胞稳态调控研讨会·深圳丨第二轮通知