科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-03
来源:BioArt
免疫检查点阻断治疗为提供了一种强有力的肿瘤治疗手段,在临床上对某些肿瘤具有很好的效果,但在某些情况下病人也会对治疗不响应。CD8+T细胞是抗肿瘤免疫的主要效应细胞,但不幸的是,肿瘤浸润CD8+T细胞经常出现耗竭或功能失常。T细胞的分化激活常常和自身的表观遗传学变化息息相关。在肿瘤微环境中,肿瘤细胞往往可以通过代谢调控,破环T细胞的表观遗传学变化,进而影响T细胞的功能。但目前尚未完全清楚,氨基酸代谢是否可以影响T细胞的表观遗传状况进而影响肿瘤组织中T细胞的功能尚待研究。
2020年9月2日,美国密歇根大学医学院邹伟平教授团队在Nature上发表题为Cancer SLC43A2 alters T cell methionine metabolism and histone methylation的文章,发现肿瘤细胞可以通过SLC43A2大量摄取甲硫氨酸,竞争性使得T细胞缺乏甲硫氨酸,从而影响T细胞的表观遗传学变化,降低T细胞的效应功能。 耗竭T细胞常展现独特的组蛋白表观遗传学变化,限制肿瘤免疫治疗。为检测氨基酸代谢和T细胞功能失常组蛋白变化的关系,研究团队利用单独缺失某种氨基酸的培养基培养CD8+T细胞,发现甲硫氨酸(methionine)的缺失导致最明显的T细胞死亡和功能失调,表明甲硫氨酸对于T细胞的存活和功能至关重要。进一步研究团队验证肿瘤细胞是否可以通过改变甲硫氨酸的水平来影响CD8+T细胞的功能,当细胞培养基中甲硫氨酸浓度低于100μ时,利用培养过肿瘤细胞的上清培养CD8+T细胞,可以诱导CD8+T细胞的凋亡,同时只有甲硫氨酸的补充可以阻止培养过肿瘤细胞的上清所诱导的T细胞凋亡和功能失调。检测肿瘤细胞和CD8+T细胞对甲硫氨酸剥夺的敏感程度,也发现CD8+T细胞对甲硫氨酸剥夺更敏感。这表明,肿瘤细胞对甲硫氨酸的竞争性摄取影响T细胞的存活和功能。
耗竭T细胞常展现独特的组蛋白表观遗传学变化,限制肿瘤免疫治疗。为检测氨基酸代谢和T细胞功能失常组蛋白变化的关系,研究团队利用单独缺失某种氨基酸的培养基培养CD8+T细胞,发现甲硫氨酸(methionine)的缺失导致最明显的T细胞死亡和功能失调,表明甲硫氨酸对于T细胞的存活和功能至关重要。进一步研究团队验证肿瘤细胞是否可以通过改变甲硫氨酸的水平来影响CD8+T细胞的功能,当细胞培养基中甲硫氨酸浓度低于100μ时,利用培养过肿瘤细胞的上清培养CD8+T细胞,可以诱导CD8+T细胞的凋亡,同时只有甲硫氨酸的补充可以阻止培养过肿瘤细胞的上清所诱导的T细胞凋亡和功能失调。检测肿瘤细胞和CD8+T细胞对甲硫氨酸剥夺的敏感程度,也发现CD8+T细胞对甲硫氨酸剥夺更敏感。这表明,肿瘤细胞对甲硫氨酸的竞争性摄取影响T细胞的存活和功能。
进一步,研究团队研究肿瘤细胞通过甲硫氨酸剥夺影响CD8+T细胞功能的机制。通过RNA-seq发现,培养过肿瘤细胞的上清可诱导T细胞凋亡特征以及更弱的TCR信号传递,此外CD8+T细胞中一碳代谢和甲硫氨酸循环在此种条件下也是缺失的,而甲硫氨酸的补充可以恢复这种缺失。代谢组学分析也发现,肿瘤上清培养的CD8+T细胞,胞内甲硫氨酸,S-adenosylmethionine (SAM), S-adenosyl-homocysteine (SAH)都有明显降低,同样的甲硫氨酸的补充可以恢复这些代谢物的水平,SAM的补充也可以阻止肿瘤上清诱导的CD8+T细胞的凋亡以及功能失调。细胞胞内甲硫氨酸被转换为SAM,作为表观遗传组蛋白甲基化的供体。研究团队检测组蛋白的甲基化情况,研究团队发现肿瘤上清诱导CD8+T细胞的H3K79me2明显降低,这种降低可以被甲硫氨酸或者SAM补充恢复。进一步机制研究发现CD8+T细胞中H3K79me2的降低,可以影响STAT5的表达,从而影响T细胞功能。
同时在小鼠体内肿瘤模型中,甲硫氨酸瘤内注射可以延缓肿瘤生长,提高肿瘤浸润CD8+T细胞H3K79me2和STAT5表达,以及T细胞的生存和细胞因子的产生。甲硫氨酸通过溶质转运家族蛋白(solute carrier family,SLC)转运到胞内,分析CD8+T细胞和肿瘤细胞SLC表达,发现甲硫氨酸转运体SLC43A2在肿瘤细胞中高表达而在CD8+T细胞中表达较低。在肿瘤细胞中用shSLC43A2降低其表达,此来源肿瘤上清对T细胞凋亡以及功能失调的诱导降低。因此,肿瘤细胞主要是通过SLC43A2和T细胞竞争甲硫氨酸,从而影响T细胞组蛋白甲基化和功能。小鼠体内模型中,肿瘤细胞中SLC43A2敲降可以提高CD8+T细胞的浸润和功能而提高抗肿瘤反应。小鼠肿瘤模型中,药理学上SLC43A2的非特异性抑制剂BCH,和抗PD-L1联合用药,也能起到有效的协同抗肿瘤效果。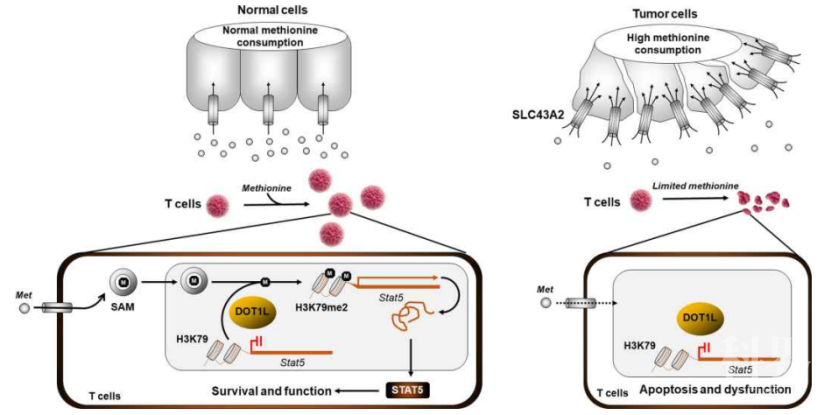
总之,本研究发现肿瘤细胞可以通过SLC43A2和T细胞竞争肿瘤微环境中的甲硫氨酸,从而影响T细胞的表观遗传学改变和功能。选择性靶向肿瘤甲硫氨酸代谢或可成为肿瘤免疫治疗有效方法。参考文献:
1. Wherry, E.J., T cell exhaustion. Nat Immunol, 2011. 12(6): p. 492-9.
2. Philip, M., et al., Chromatin states define tumour-specific T cell dysfunction and reprogramming. Nature, 2017. 545(7655): p. 452-456.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652497989&idx=1&sn=9eb7396d29623df593b0c23bcae5b333&chksm=84e27bf1b395f2e7d51bbbb90068545c1269d3309bdc03803df64a3f420d6335dd7e03008576#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

生物钟调控代谢新方式揭示
组蛋白甲基化修饰控制抗原受体基因多样性的产生
遗传发育所发现植物组蛋白去甲基化酶招募的新机制
研究揭示拟南芥组蛋白去甲基化酶JMJ13的结构功能
癌症演化树:揭示癌症转移机制



研究揭示植物SUVH家族组蛋白甲基化酶的调控机理

Plant Cell:拟南芥组蛋白去甲基化酶JMJ28调控开花的分子机制
文波组发现组蛋白去甲基化酶KDM7A相分离形成新型核体
科学家用灵芝当妙药 “饿死”肿瘤细胞
蛋白复合物Paf1:携带基因致病的奥秘