科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-04-27
来源:CBG资讯
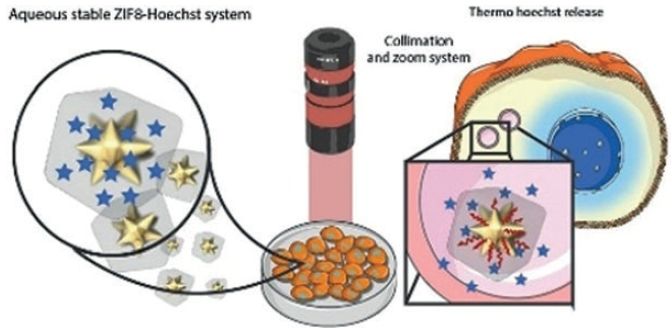
由金属阳离子和多齿有机配体组成的金属有机骨架材料(Metal-organic-frameworks,MOFs)具备多孔、生物稳定性以及可以高效装载并控制药物释放等优点,因此已经成为了一种具有前景的纳米药物载体。尽管如此,MOFs药物载体在液体环境中的不稳定性限制了其发展,最有代表性的具有生物相容性的微孔沸石咪唑骨架材料(zeolitic imidazolate framework 8,ZIF-8)就由于其在水中的稳定性不佳,暴露在生理环境后10小时内会释放80-90%的药物。
近日,西班牙圣地亚哥·德·孔波斯特拉大学Pablo del Pino博士课题组、IMDEA Energy公司Patricia Horcajada博士及罗维拉·威尔吉利大学Ramon A. Alvarez-Puebla教授课题组合作,设计了一种基于ZIF-8的纳米复合物(nanocomposite,NC),其由两亲性聚合物聚[异丁烯–马来酸酐]–g–十二烷基(PMA)稳定的ZIF-8包裹金纳米星(nanostars,NSs)形成,该研究解决了ZIF-8在液体环境中不稳定的问题。这种复合物具有和传统ZIF-8相当的载药效率,可以在液体环境中稳定存在,同时还可以在近红外光(near-IR,NIR)的照射下快速释放药物,作者在水溶液及细胞中验证了这个NC的性能,相关研究成果发表在Angew. Chem. Int. Ed.上(DOI: 10.1002/anie.201902817),题为“Aqueous Stable Gold nanostar/ZIF-8 Nanocomposites for Light Triggered Release of Active Cargo Inside Living Cells”。
(图片来源:Angew. Chem. Int. Ed.)
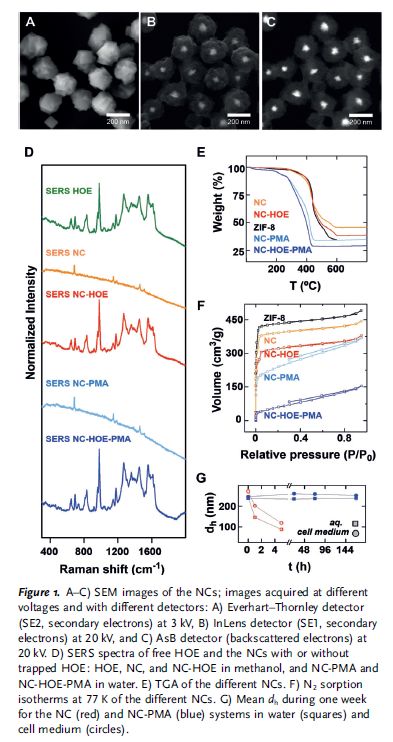
作者以可以被770 nm激发光激活的NSs作为种子合成了ZIF-8,优化后的NCs呈多面体形貌,平均大小为218±24 nm(Figure 1A-C)。作者选择了双苯酰亚胺复合物Hoechst H33258(HOE)作为模式药物,这是一种常用于染细胞核的荧光染料,它被释放后可以和DNA结合,然后发出更强(30:1)、波长更短(461 nm vs. 520 nm)的荧光。作者先将NCs放入HOE甲醇溶液中孵育得到了包载HOE的NCs(NC-HOE),然后将NC-HOE与PMA一起孵育得到了PMA包裹的NC-HOE(NC-HOE-PMA),由于包载过程中一部分染料释放,因此最终负载的HOE只有初始值的40%,而包载前后NC-HOE的光学性质基本无变化(Figure 1D);此外,作者还对这些NC进行了热重分析(Figure 1E)和氮气吸附测试(Figure 1F)。接下来,作者分别检测了NC和PMA-NC在水溶液和细胞培养基中的稳定性,结果显示NC在5小时内就快速降解,而PMA-NC在其中孵育一周以后粒径也没有明显变化(Figure 1G),表明这种PAM-NC在液体环境中具有优异的稳定性。
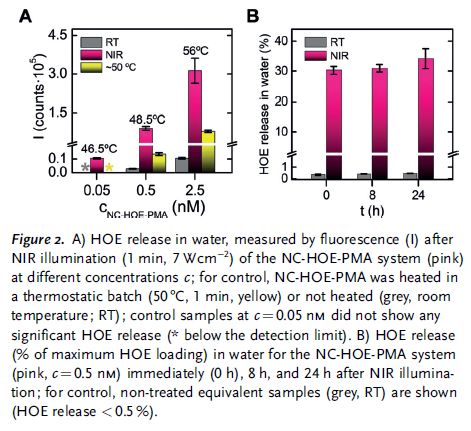
作者接下来研究了NC-HOE和NC-HOE-PMA的热等离子体行为(Figure 2)。作者利用NIR照射不同浓度的材料,结果发现溶液的温度随着材料的浓度增加而增加。随后作者将这些溶液离心,通过荧光分析定量了HOE的释放,结果显示NIR照射的材料(无论是NC-HOE还是NC-HOE-PMA)释放HOE的量都远远高于加热组和无照射组。在无NIR照射的情况下,随着时间延长(0、8、24 h),NC-HOE-PMA水溶液和磷酸盐缓冲液中释放HOE的量都低于1%,而NC-HOE的甲醇溶液会释放20%的HOE(24 h)。在有NIR照射的情况下,NC-HOE-PMA会快速释放30%的HOE,停止照射后HOE几乎不再释放;而NC-HOE一开始就会释放10%,释放量会随着时间逐渐增加。
(图片来源:Angew. Chem. Int. Ed.)
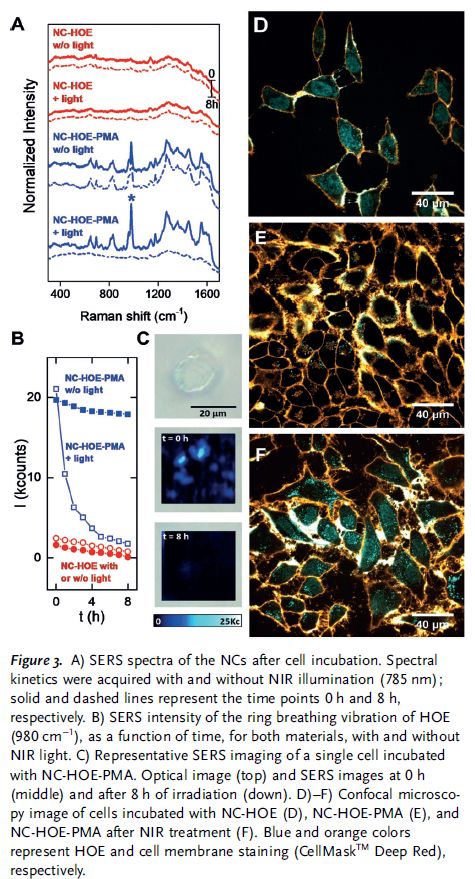
最后,作者研究了NC-HOE和NC-HOE-PMA在活细胞内释放HOE的情况,作者将不同浓度的材料和细胞共同孵育,结果发现两种材料都具有浓度相关的细胞毒性。作者利用配置SERS成像系统的共聚焦显微镜对胞内的药物输送过程进行了追踪。SERS成像结果显示和NC-HOE孵育的细胞内无HOE的信号,这是由于ZIF-8在进入细胞之前就被降解,而和NC-HOE-PAM孵育的细胞内可以检测到清晰的HOE信号(Figure 3A-C)。实时监控发现NIR照射的前2小时会释放约75%的HOE,而到8小时时基本没有HOE的信号,表明HOE已经被降解。共聚焦显微观察的数据(Figure 3D-F)显示NC-HOE-PAM会富集在细胞内特定区域(比如溶酶体),NIR照射之后会快速释放HOE与DNA结合。而NC-HOE由于在培养基中降解,因此可以直接进入细胞核,与细胞核共定位。
(图片来源:Angew. Chem. Int. Ed.)
总而言之,该研究开发了一种可以在液体环境(甚至细胞)中稳定存在的基于ZIF-8的纳米材料,具有热等离子效应和较高的药物装载效率。这种材料在正常情况下几乎不释放药物,而一旦接受NIR照射,就会快速释放装载的药物,因此可以用于药物的定点、定时控制释放。
来源:BeanGoNews CBG资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4ODQ0NjUwMg==&mid=2247494437&idx=2&sn=b8ab6fd6e5207f4de678fedf0d5fb8c6&chksm=ec3cea6cdb4b637a2a11d7c4379a68f282eea3773ad0b3447978fb1493e73fc7903902b5d0e8&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

首批鼓励仿制药品目录公布,33种药品入选!

2021年国家医保药品目录调整结果公布:新增74种药品
2016药物/化学品致癌性试验研究高级培训班在青岛举行
中国抗癌协会抗癌药物专业委员会召开换届会议




问答 | 同种药品的过评药品是否执行同一价格销售?

这些药品降价了!

药品有效期≠使用期,这些药品安全常识你应该知道

关注 | 119种药品新纳入医保!含治疗新冠肺炎药品

新版药品管理法:未经批准进口药品不再列为假药
【新科技知识干部读本】海洋药物研究有利于新药研发