科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-05
来源:上海科协
近日,由复宏汉霖研发的首个国产生物类似药“汉利康”(利妥昔单抗注射液)获批上市,用于治疗非霍奇金淋巴瘤。该产品不但填补了我国生物类似药市场的空白,而且相比罗氏公司的原研药“美罗华”,价格低了三成左右,惠及国内广大淋巴瘤患者。

2015年,国家食药监局发布《生物类似药研发与评价技术指导原则(试行)》,明确和规范了生物类似药的定义、研发和评价工作。生物类似药是指在质量、安全性、有效性方面与已获准注册的参照药具有相似性的治疗用生物制品。与原研药相比,生物类似药没有临床意义上的差异,无论是纯度、杂质含量还是生物免疫活性等指标,都在原研药的一定范围内。
但生物类似药的研发难度很大,被称为“仿制药中的创新药”。与化学仿制药相比,生物类似药研发周期长、费用高、难度大,具有较高的准入门槛。复宏汉霖联合创始人、总裁兼首席执行官刘世高博士介绍,生物类似药研发的一大难点是生产工艺的开发。与化学仿制药不同,生物类似药用活的细胞来生产,而生产工艺决定了生产质量。对于原研药来说,生产工艺是保密的,因此研发人员需要通过“反向工程”来摸索工艺,找出适合细胞的培养环境。整个过程十分漫长,对技术要求相当高,且需要大量的资金投入。

中国医学科学院肿瘤医院副院长石远凯教授说,复宏汉霖研发的利妥昔单抗注射液严格参照美国、欧盟的生物类似药开发的指导原则进行研发,每一步都与“美罗华”进行“头对头”比对试验,达标后才进入下一步。临床前的对比数据显示,两种药品在理化特性、功能特性上高度相似。后续3次重要的临床试验,对安全性、耐受性、疗效、免疫原性等进行研究,结果表明没有显著的统计学差异,具有高度相似的疗效与安全性。
中国医药创新促进会执行会长宋瑞霖表示,首个生物类似药获批对于中国医药创新历程而言具有里程碑意义。回望生物类似药的发展,欧洲和美国较中国相对领先。但是,从汉利康上市可以得到这样一个信息,在小分子药领域中国与欧美大概有近20年的差距,而对生物类似药的开发现在只有3到4年的差距。这意味着中国生物医药产业已经处于从“跟跑”转向“并跑”的关键节点。

来源:SHKX47 上海科协
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NTExMTUxNA==&mid=2653012444&idx=2&sn=34548c9431ab965bc482ac36e33516db&chksm=84098669b37e0f7f99a681b8c88f89eee004420a130f04444b9c3e794881fa6bdce2006800d6&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

用生物技术保护生物多样性 中国这样做

“厕所革命”里的生物技术
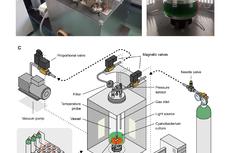
为火星“定制”的生物技术——蓝藻培养系统
生物技术:制造新肠道
生物技术启发下的信息技术革新

我们身边的好人—--魏文
2016药物/化学品致癌性试验研究高级培训班在青岛举行
中国毒理学会2017年活动计划
夏季太阳毒,小心“日光性皮炎”!
中国春兰生物技术繁殖