科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-09
来源:中国生物物理学会
作者 ∣潘永春
责编 ∣王相宜
近日,来自南京大学、厦门大学和南京工业大学的科研人员开发出一种“基因剪刀”工具的新型载体,可以通过近红外光控制“修剪”基因的方式,实现体内时间和空间上的基因编辑可控。该技术在癌症等重大疾病治疗方面具有广阔的应用前景,相关工作已发表于Science Advances.
被誉为“基因魔剪”的CRISPR-Cas9是一种靶向修正生命体DNA的工具,由一段向导RNA (sgRNA) 和蛋白(核酸内切酶Cas9)组成,是当下最热门的基因编辑工具之一。它如同DNA的外科医生一样,其原理可以分为两大功能部分:一是 “检查”识别,即确认“手术部位”,寻找向点基因,这部分功能由sgRNA完成;二是“切除”目标位置,也就是对目标基因进行敲除,这部分依靠蛋白Cas9来实现。然而,这把“基因魔剪”分子量比较大,而且RNA和酶在体内很容易被其他酶破坏,因此深入了解如何有效地将这把“基因魔剪”导入细胞,以及如何控制它,使它可以按照人们的需求,在特定的时间和部位发生作用非常重要。
目前将CRISPR-Cas9递送进入活细胞内的方法,包括电穿孔(electroporation),微注射(microinjection)等物理方法,以及病毒载体、非病毒载体等。但是物理方法会对细胞活性产生一定影响;病毒载体在递送“基因剪刀”的同时,还可能同时“夹带私货”,将自己的基因也给一并运进细胞,引发宿主细胞内部基因突变,甚至导致细胞癌化,因此在临床的应用存在一定的风险。近年来,一些非病毒载体开始被开发并被用于CRISPR-Cas9体系的运输中。这些非病毒载体包括:1)脂质体和有机聚合物;2)无机纳米材料,如金簇,石墨烯,黑磷等;3)其他物质,比如DNA纳米线团,金属有机框架等。虽然这些非病毒载体具有强的“送货”能力,能较好地将CRISPR-Cas9体系递送进细胞,然而,运输到哪,何时“派件”,这些载体“一头雾水”。
宋玉君教授课题组致力于开发高效的“基因魔剪”载体,希望能从空间和时间上对体内基因组编辑进行精确控制。他们在上转换纳米粒子(UCNPs)和Cas9之间添加了一把近红外(NIR)响应的“光锁”,设计出了一种的远程操纵的基因编辑技术。具体来说,该系统利用光敏分子将CRISPR-Cas9体系共价“锁”在UCNPs上,并且修饰上一层高分子材料后,该复合纳米粒子可被细胞大量内吞。之后,在近红外光照射下,UCNPs可发射出紫外光,打开Cas9蛋白和上转换纳米粒子之间的“锁”,从而释放出蛋白,使蛋白得以进入细胞核,实现基因剪切(如下图)。由于红外光的强组织穿透性,因此,该技术有望在深层组织中实现CRISPR-Cas9基因编辑的精确调控。
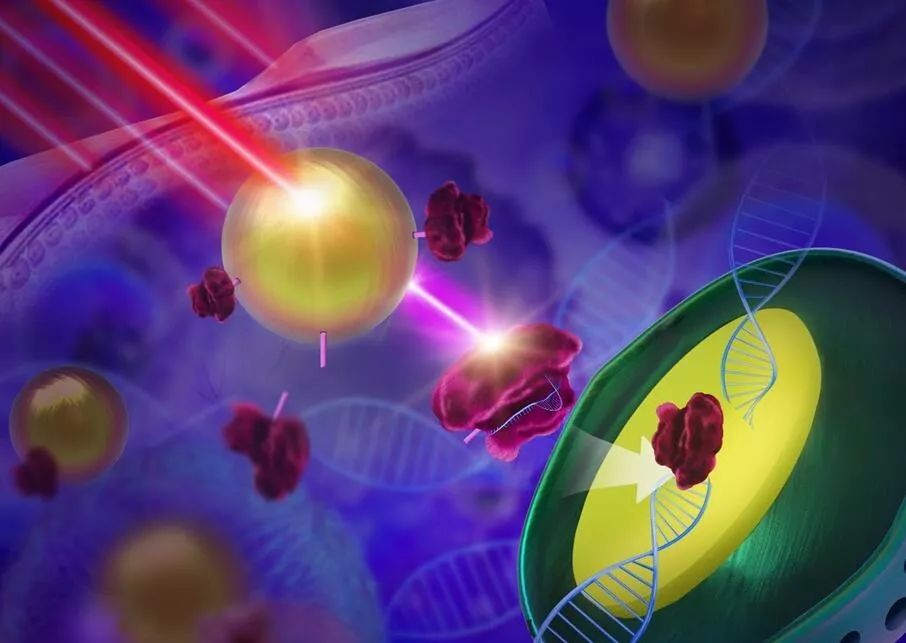
这种远程操纵的基因编辑系统在细胞中和体内皆表现出优异的近红外光响应的基因剪切能力。当CRISPR-Cas9靶向到一段肿瘤癌基因(Plk-1)后,可在红外光的调控下,对靶点基因实现敲除,从而诱发肿瘤细胞凋亡。该团队从基因、蛋白及细胞等多各个角度对该体系的有效性进行了验证。此外,这一系统在小鼠活体上的近红外光响应的能力也得到了验证。在对荷瘤小鼠进行治疗的过程中发现,只有近红外光照射实验组的肿瘤得到了有效抑制,且从20天后取下肿瘤大小来看,实验组肿瘤远远小于对照组。
这项技术利用外界光照这种无创的外部手段,实现了目标部位基因编辑,显著提高了基因编辑的靶向性。由于近红外光有效的组织穿透性,为该技术为在深层组织中的应用提供了潜在的可能。总之,这种远程操纵的基因编辑技术打开了时空调控基因编辑的大门,为基因编辑技术在疾病治疗方面的应用提供了新的思路。
相关工作发表于Science Advances ( DOI: 10.1126/sciadv.aav7199),南京大学为第一通讯单位,硕士生潘永春为本论文的第一作者,南京大学现代工程与应用科学学院宋玉君教授为通讯作者,厦门大学林友辉副教授和南京工业大学王玉珍副研究员为共同通讯作者。该项研究得到国家自然科学基金,江苏省自然科学基金和江苏省双创人才等项目的资助。


中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979

来源:BSC-1979 中国生物物理学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NjE1NTQ5Mg==&mid=2649498362&idx=1&sn=ddb87f02b63bd4b3cd349b5c7c3d0794&chksm=87d58b71b0a202671daf261ac684871a6939355273149a91d49221c3df079e96dc94b352b3c1&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
编辑基因创造超人,霍金的担心是不是杞人忧天




基因编辑有重大新进展!两大突破可高效精准矫正致病的遗传突变

Science:科学家发现新型基因编辑工具,体积是CRISPR-Cas9的一半!
利用免疫正交直向同源物有望提高CRISPR-Cas9基因组编辑效率

一种超快的CRISPR-Cas9基因编辑技术 几秒钟内实现精准基因编辑!

蚊子怕怕了,利用转基因能破坏它们生育能力,必死无疑
同样搞基因编辑,贺建奎 黄军就何以评价两极化


超越CRISPR-Cas9的“DNA碎纸机”
微生物所在酵母中开发CRISPR-Cas9介导的多重基因组编辑新技术

一年前,他就知道了贺建奎的疯狂计划