科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-11
来源:BioArt
撰文 | 敏君
烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide, NAD)是生物体氧化还原反应中非常重要的辅酶,它携带高能电子,通过可逆性的氧化还原介导氧化磷酸化【1】;并且作为NAD依赖性酶类的底物,将细胞代谢与表观遗传调控和DNA损伤修复联系起来【2】。NAD水平在衰老过程中逐渐降低,补充NAD前体物质会延缓线虫、果蝇和小鼠等动物的衰老【3-4】。最近研究发现NAD与肿瘤发生密切相关,NAD会促进衰老细胞分泌促炎因子,刺激肿瘤细胞生长【5】。哺乳动物细胞通过三条途径合成NAD:一是以色氨酸为原料的从头合成途径,二是以烟酸为原料的Preiss-Handler(PH)途径,三是以烟酰胺(NAM)或烟酰胺核苷为原料的补救合成途径【6】。到目前为止,决定NAD合成途径选择方式的分子机制尚不清楚。
2019年4月25日,来自加州大学圣地亚哥分校Ludwig癌症研究所的Paul Mischel教授团队在 Nature 杂志发表文章NAD metabolic dependency in cancer is shaped by gene amplification and enhancer remodelling,揭示了组织-种系起源的癌症其基因扩增和表观遗传重塑依赖于NAD途径,表明靶标NAD代谢进行基因型选择、药物可操作依赖是进行癌症精准治疗的潜在途径。

作者对216例癌症研究的63,856个样品进行了分析,结果表明PH合成途径、补救合成途径和NAD从头合成途径的限速酶——烟酸盐磷酸核糖转移酶(NAPRT)、烟酰胺磷酸核糖转移酶(NAMPT)和喹诺酸盐磷酸核糖转移酶(QAPRT)(图1),在肿瘤发生中的突变频率不到1%。然而,NAPRT和NADSYN1的DNA拷贝数在包括前列腺癌、卵巢癌和胰腺癌等许多类型癌症中均有所增加,作者发现组织微环境决定了某些特定类型的肿瘤组织NAPRT发生扩增。
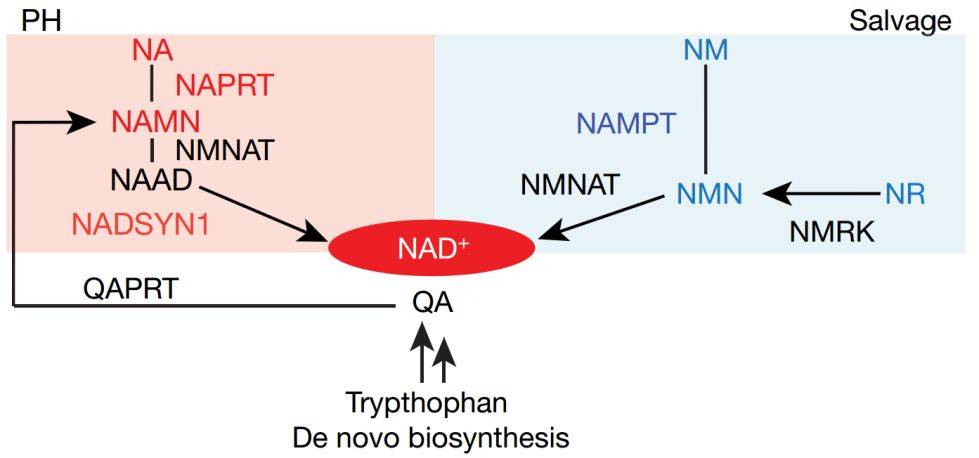
图1 NAD+生物合成途径
非肿瘤细胞能够利用所有的NAD合成途径以维持胞内NAD水平,用NAMPT特异性抑制剂和小RNA干扰(siRNA)分别抑制三条NAD合成途径,并不影响非癌细胞的存活。相反,具有NAPRT扩增和/或NADSYN1基因扩增(PH扩增)特征的29种癌细胞系的存活全部依赖于NAPRT和NADSYN1,而25种无PH扩增的细胞系的存活均不依赖于NAPRT和NADSYN1两种蛋白。针对NAD从头合成关键酶或PH和补救途径的shRNAs干扰实验证实,PH扩增的癌细胞完全依赖于PH途径来维持NAD合成和细胞存活。相比之下,非PH扩增的癌细胞系则完全依赖于NAMPT和补救合成途径。
为检测组蛋白H3第27位赖氨酸的乙酰化(H3K27ac)水平,作者进行了ChIP-seq,发现位于7号染色体NAMPT转录起始位点下游65kb处,有一个远程NAMPT增强子,该增强子具有补救途径依赖性的H3K27ac特异性标记和/或DNase I超敏感(DNase I hypersensitive site, DHS)信号,而在PH扩增的癌细胞或正常细胞系中均不存在。将该4.641 kb的顺式调控区域克隆至NAMPT启动子上游或下游,该区域在依赖补救途径的癌细胞系中表现出潜在的增强子活性,而不影响PH扩增性或非癌细胞系。对该预测的增强子进行精细定位,发现增强子“B”区域对于NAMPT增强子活性是必需的。CRISPR干扰实验表明增强子“B”能够控制NAMPT基因表达;是H3K27乙酰化作用的靶标;能调控细胞内NAD水平;是补救途径依赖性癌细胞以NAD依赖性方式存活所不可或缺的。ChIP-qPCR和荧光素酶报告基因检测表明c-MYC和MAX转录因子能在补救途径依赖性癌细胞中特异性调节NAMPT增强子活性。
NAPRT扩增性肿瘤细胞专一性地利用PH途径调节NAD稳态并维持生存。联合抑制NAMPT和NMRK1会导致肿瘤内NAD水平下降,导致肿瘤完全性和持久性的退化,以及体内大量癌细胞死亡,证明了在非PH扩增性肿瘤治疗中需联合抑制NAMPT和NMRK1蛋白。为确定肿瘤发生中的NAD生物合成依赖性是否具有药理学上的可行性,作者利用细菌NADSYN1抑制剂NADSYN1i处理不同的肿瘤组织,发现NADSYN1i能抑制人原NADSYN1活性,并能选择性抑制PH扩增性癌细胞系的生长和NAD水平,而对正常细胞和非PH扩增性细胞系没有明显影响。此外,NADSYN1i能显著性抑制NAPRT扩增性OV4卵巢瘤生长,并能降低小鼠瘤内NAD水平,但对补救途径依赖性的H460肺癌的生长和肿瘤内NAD水平影响很小。与之相反,MAMPT抑制剂FK-866能在体外选择性抑制补救途径依赖性肿瘤细胞系和小鼠H460肺癌的生长,但在体内对PH扩增性OV4卵巢瘤没有影响。此外,肿瘤发生过程中可能会发生进一步的变化,以促进NAD通路的选择习惯性(图2)。
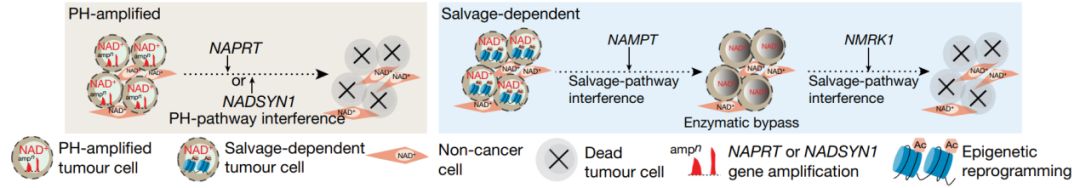
图2 肿瘤中NAD代谢的分子基础
如何将有关癌症代谢的生化和遗传图景转化为有效的临床治疗,是目前医学界面临的一个巨大挑战。局部组织微环境、种系依赖性的转录调控和肿瘤细胞基因型改变是肿瘤发生的重要影响因素,且三者间存在着复杂的相互作用,但这种相互作用如何影响癌细胞赖以生存的特定酶类,目前尚不清楚。本研究中,作者证明了肿瘤发生过程中对NAD通路的依赖性和选择性是由基于组织谱系的基因扩增和表观基因重塑决定的,揭示了基因型选择的药理学操作依赖性可被用于开发针对NAD代谢的更有效、更精确的癌症治疗方法。
原文链接:
https://doi.org/10.1038/s41586-019-1150-2
制版人:珂
参考文献
1. Ryu, K. W., Nandu, T., Kim, J., Challa, S., DeBerardinis, R. J., & Kraus, W. L. (2018). Metabolic regulation of transcription through compartmentalized NAD+ biosynthesis. Science, 360(6389), eaan5780.
2. Vander Heiden, M. G. & DeBerardinis, R. J. (2017). Understanding the intersections between metabolism and cancer biology. Cell 168, 657–669.
3. Mouchiroud, L., Houtkooper, R. H., Moullan, N., Katsyuba, E., Ryu, D., Cantó, C., ... & Guarente, L. (2013). The NAD+/sirtuin pathway modulates longevity through activation of mitochondrial UPR and FOXO signaling. Cell, 154(2), 430-441.
4. Yoshino, J., Mills, K. F., Yoon, M. J., & Imai, S. I. (2011). Nicotinamide mononucleotide, a key NAD+ intermediate, treats the pathophysiology of diet-and age-induced diabetes in mice. Cell metabolism, 14(4), 528-536.
5. Nacarelli, T., Lau, L., Fukumoto, T., Zundell, J., Fatkhutdinov, N., Wu, S., ... & Noma, K. I. (2019). NAD+ metabolism governs the proinflammatory senescence-associated secretome. Nature cell biology, 21(3), 397.
6. Katsyuba, E., Mottis, A., Zietak, M., De Franco, F., van der Velpen, V., Gariani, K., ... & Giacchè, N. (2018). De novo NAD+ synthesis enhances mitochondrial function and improves health. Nature, 563(7731), 354.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469724&idx=3&sn=159eaf5f845c1ed8c1b5793910f13ad2&chksm=84e2ea68b395637e6806aee7ca6fd1805e0059028b3870958117764a250bdc87d6914177f3b1&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
【癌症知多少】肺癌那些事儿:什么是靶向治疗?

Science : 结直肠癌细胞发生适应性突变以应对靶向治疗

俄研制出癌症靶向治疗新方法
癌症新发现:癌细胞能“传染”附近健康细胞

生物学家成功使癌细胞变成正常细胞!癌症有救了?

癌症治疗的概念性突破:三特异性抗体靶向治疗方法
癌症转移,癌细胞最容易转移至哪些部位?
特异性靶向TrxR的多功能Au(I) 基AIEgens用于癌细胞治疗和成像
癌症: 正在扩散当中的早期转移癌细胞的捕捉
基因编辑技术将癌细胞变身为健康细胞