科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-16
来源:BioArt
脊椎动物进化出先天免疫系统和适应性免疫系统来对抗感染、疾病和其他不必要的生物入侵。先天免疫系统是机体应对这些挑战的第一道防线,利用各种类型的模式识别受体 (PRRs) 感知病原体相关分子模式 (PAMPs) 或损伤相关分子模式 (DAMPs),从而协调机体作出快速和多方面的反应 【1】。胞质内的某些PRRs识别特定的刺激,形成一个大的蛋白复合物结构,称为炎症小体。
经典炎症小体如NLRP1, NLRP3, NAIP-NLRC4, AIM2和 Pyrin 炎症小体的组装激活炎性 caspase-1,导致“警报”细胞因子pro-IL-1β和pro-IL-18的水解和释放,刺激免疫反应来消除潜在的威胁 【2,3】,作为非经典炎症小体受体,caspase-4/5/11 直接被内毒素的主要成分LPS激活并组装炎症小体 【4】。这些炎性caspase激活成孔蛋白gasdermin D (GSDMD),导致裂解性细胞焦亡 【5-7】。
北京生命科学研究所邵峰实验室近年来在天然免疫领域取得了一系列原创成果,除了将细胞焦亡重新定义为gasdermin介导的程序性细胞坏死之外【 6-9】,还鉴定出了多个炎症小体通路及新的PAMP分子,包括:1) NAIP家族蛋白直接识别细菌鞭毛素蛋白和病原菌三型分泌系统的结构组分蛋白 【10】;2) Pyrin蛋白 (遗传突变导致家族性地中海热自炎症疾病) 间接感知多种病原菌和毒素对宿主Rho家族小G蛋白的修饰和失活,进而定义了一条全新的炎症小体信号通路 【11】;3) caspase-4/5/11作为LPS的胞内受体组装非经典炎症小体诱导焦亡,是LPS导致脓毒症的关键机制 【4】。4) 细菌LPS合成通路的七碳糖代谢中间产物ADP-heptose是激活宿主免疫通路的新的PAMP分子,ALPK1作为一种全新的PRR直接识别ADP-heptose,通过ALPK1-TIFA通路激活NF-B天然免疫通路【12】。
近日,中国农业大学董娜研究组和北京生命科学研究所邵峰研究组合作在致病菌感染与天然免疫研究中取得新进展,阐明了一种机体拮抗病原菌感染的、独特的天然免疫受体激活模式,相关成果以“The N-end rule ubiquitin ligase UBR2 mediates NLRP1B inflammasome activation by anthrax lethal toxin” 为题在The EMBO Journal杂志上以长文形式发表【 13】。

作为第一个被报道能形成炎症小体复合物的NLR家族蛋白1,NLRP1炎症小体的激活机制备受关注。以前的研究报道,炭疽致死毒素 (Anthrax lethal toxin,LT) 利用其金属蛋白酶活性特异性地诱导鼠巨噬细胞NLRP1B炎症小体的活化和细胞焦亡 【14】,但其潜在机制尚不清楚。在这一研究中,研究人员建立了一个简单而强大的双荧光细胞报告系统检测LT诱导的NLRP1B炎症小体通路ASC蛋白的聚集成点和裂解性细胞焦亡。利用该系统,他们进一步采用全基因组siRNA筛选和CRISPR-Cas9敲除筛选,寻找参与LT诱导炎症小体活化的基因。两个筛选结果表明UBR2,一种N端规则降解途径的E3泛素连接酶,是LT诱导的NLRP1B炎症小体激活所必需的。
以前的研究表明,LT在NLRP1B的Lys44后酶切和NLRP1B的FIIND结构域的自水解 (F983-S984),都是NLRP1B炎症小体激活的必要前提【15-17】。研究人员通过进一步研究发现UBR2通过识别NLRP1B蛋白被LT酶切后新产生的N末端Leu启动NLRP1B自身的泛素化和随后被蛋白酶体降解,从而导致C端CARD结构域的释放,激活下游capase-1 (图1)。此外,E2泛素结合酶UBE2O通过与UBR2的结合也参与在这个过程中。这种蛋白降解激活模式不同于任何一种已知的NLR炎症小体,不需要保守的NBD结构域介导寡聚组装,甚至不需要完整的NLR分子,C端的CARD结构域连接一段自水解后产生的FIIND结构域片段足以启动NLR的寡聚和炎症小体的组装。
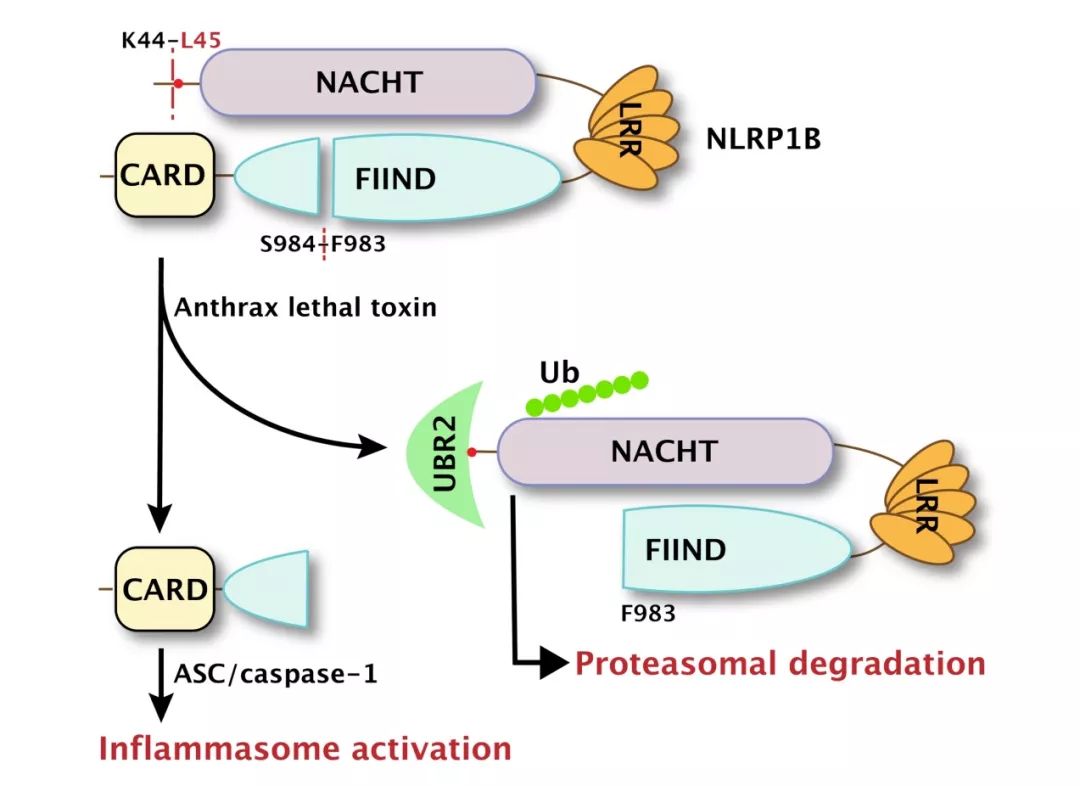
图1:炭疽致死毒素激活NLRP1B炎症小体的模式图。
就在大约一个月前,在同期Science上发表了两篇关于NLRP1B活化机制的背靠背研究(Science 背靠背| 破解NLRP1炎症小体的活化之谜),分别来自加州大学伯克利分校的Russell E.Vance团队和纪念斯隆凯特琳癌症中心的Daniel A. Bachovchin团队 【18,19】。这两篇研究成果也分别阐述了NLRP1B炎症小体通过泛素蛋白酶体途径降解后发生活化的分子机制。这三项独立的研究成果非常确切的阐明了炭疽致死毒素激活NLRP1B炎症小体的独特的激活模式及其分子机制,解决了一个困扰天然免疫领域长达几十年的谜团。
参考文献
1. Martinon F, Burns K, Tschopp J (2002) The inflammasome: a molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell 10: 417-26.
2. Broz P, Dixit VM (2016) Inflammasomes: mechanism of assembly, regulation and signalling. Nat Rev Immunol 2016; 16: 407-20.
3. Zhao Y, Shao F (2016) Diverse mechanisms for inflammasome sensing of cytosolic bacteria and bacterial virulence. Curr Opin Microbiol 29: 37-42.
4. Shi JJ, Zhao Y, Wang YP, Gao WQ, Ding JJ, Li P, Hu LY, Shao F (2014) Inflammatory caspases are innate immune receptors for intracellular LPS. Nature 514, 187-92.
5. Kayagaki N, Stowe IB, Lee BL, O'Rourke K, Anderson K, Warming S, Cuellar T, Haley B, Roose-Girma M, Phung QT, Liu PS, Lill JR, Li H, Wu J, Kummerfeld S, Zhang J, Lee WP, Snipas SJ, Salvesen GS, Morris LX et al. (2015) Caspase-11 cleaves gasdermin D for non-canonical inflammasome signalling. Nature 526: 666-71.
6. Ding J, Wang K, Liu W, She Y, Sun Q, Shi J, Sun H, Wang DC, Shao F (2016) Pore-forming activity and structural autoinhibition of the gasdermin family. Nature 535: 111-6.
7. Shi J, Zhao Y, Wang K, Shi X, Wang Y, Huang H, Zhuang Y, Cai T, Wang F, Shao F (2015) Cleavage of GSDMD by inflammatory caspases determines pyroptotic cell death. Nature 526: 660-5.
8. Wang Y, Gao W, Shi X, Ding J, Liu W, He H, Wang K, Shao F (2017) Chemotherapy drugs induce pyroptosis through caspase-3 cleavage of a gasdermin. Nature, 547(7661):99-103.
9. Shi JJ, Gao WQ, Shao F (2017) Pyroptosis: Gasdermin-Mediated Programmed Necrotic Cell Death. Trends Biochem Sci, 42 (4): 145-154.
10. Zhao Y, Yang JL, Shi JJ, Gong YN, Lu QH, Xu H, Liu LP, Shao F (2011) The NLRC4 inflammasome receptors for bacterial flagellin and type III secretion apparatus. Nature 477, 596–600.
11. Xu H, Yang JL, Gao WQ, Li L, Li P, Zhang L, Gong YN, Peng XL, Xi JJ, Chen S, Wang FC, Shao F (2014) Innate immune sensing of bacterial modifications of Rho GTPases by the Pyrin inflammasome. Nature 513, 237–41
12. Zhou P, She Y, Dong N, Li P, He H, Borio A, Wu Q, Lu S, Ding X, Cao Y, Xu Y, Gao W, Dong M, Ding J, Wang DC, Zamyatina A, Shao F (2018) Alpha-kinase 1 is a cytosolic innate immune receptor for bacterial ADP-heptose. Nature 561(7721):122-126.
13. Xu H, Shi JJ, Gao H, Liu Y, Yang ZX, Shao F, Dong N (2019) The N-end rule ubiquitin ligase UBR2 mediates NLRP1B inflammasome activation by anthrax lethal toxin, EMBO J e101996.
14. Boyden ED, Dietrich WF (2006) Nalp1b controls mouse macrophage susceptibility to anthrax lethal toxin. Nat Genet 38: 240-4.
15. Levinsohn JL, Newman ZL, Hellmich KA, Fattah R, Getz MA, Liu S, Sastalla I, Leppla SH, Moayeri M (2012) Anthrax lethal factor cleavage of Nlrp1 is required for activation of the inflammasome. PLoS Pathog 8: e1002638.
16. Finger JN, Lich JD, Dare LC, Cook MN, Brown KK, Duraiswami C, Bertin J, Gough PJ (2012) Autolytic proteolysis within the function to find domain (FIIND) is required for NLRP1 inflammasome activity. J Biol Chem 287: 25030-7
17. Frew BC, Joag VR, Mogridge J (2012) Proteolytic processing of Nlrp1b is required for inflammasome activity. PLoS Pathog 8: e1002659
18. Sandstrom A, Mitchell PS, Goers L, Mu EW, Lesser CF, Vance RE (2019) Functional degradation: A mechanism of NLRP1 inflammasome activation by diverse pathogen enzymes. Science 364 (6435) pii: eaau1330.
19. Chui AJ, Okondo MC, Rao SD, Gai K, Griswold AR, Johnson DC, Ball DP, Taabazuing CY, Orth EL, Vittimberga BA, Bachovchin DA (2019) N-terminal degradation activates the NLRP1B inflammasome. Science 364 (6435): 82-85.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652469977&idx=5&sn=eaa9489e89b412638651ea5ac0ae4753&chksm=84e2e96db395607b00cf7872ef0e750be840ac8092211ddc1851bc13a17655f1c96729c109e2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn