科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-05-25
来源:iNature
原标题:PNAS | 清华大学黄善金团队揭示CAP1在花粉管中介导顶端肌动蛋白聚合的分子机制
肌动蛋白细胞骨架涉及许多基本的生理细胞过程。大多数基于肌动蛋白的功能(如果不是全部的话)由肌动蛋白的聚合形式进行。因此,该领域的核心问题是肌动蛋白单体如何快速组装成肌动蛋白丝并组织成不同的结构以满足各种生理和细胞过程的需要。CAP,在芽殖酵母中也称为Srv2p,已经成为这一过程中的重要参与者。它最初被鉴定为腺苷酸环化酶相关蛋白,Srv2p / CAP通过将肌动蛋白单体转移至profilin并随后将肌动蛋白亚基递送至肌动蛋白丝的带刺末端而从ADF-ADP-G-肌动蛋白复合物释放肌动蛋白单体。然而,CAP1的一些方面在肌动蛋白聚合中起作用 - 特别是其肌动蛋白核苷酸交换活性对该过程的贡献 - 仍然在很大程度上未知。
2019年5月24日,清华大学生科院黄善金团队在国际权威期刊PNAS上发表题为“Mechanism of CAP1-mediated apical actin polymerization in pollentubes”的文章,提出CAP1与ADF和profilin协同作用以驱动花粉中的肌动蛋白更新,从而促进ATP-G-肌动蛋白 - profilin复合物的形成,以供给膜锚定的formins以驱动顶端肌动蛋白聚合和正常的花粉管生长。

研究人员检查了CAP1的表达对花粉管中肌动蛋白细胞骨架的影响。最初发现肌动蛋白丝变得更亮并且更严重地捆绑,并且在cap1花粉管的柄部区域中肌动蛋白丝的量增加。因此,发现CAP1的过表达导致整个花粉管中F-肌动蛋白的量减少。令人惊讶的是,研究人员还发现肌动蛋白丝变得更暗,并且与WT花粉管相比,在cap1花粉管的顶端区域内肌动蛋白丝的量减少。结果表明CAP1的功能丧失对花粉管的不同区域内的肌动蛋白动力学具有不同的影响。
接下来探究CAP1对花粉管不同区域内肌动蛋白动力学的不同影响是否是由花粉管中CAP1的不同细胞内定位引起的。上述数据表明,由天然CAP1启动子驱动的CAP1-EGFP融合构建体引入cap1突变体,完全拯救了cap1-1突变体的发育缺陷和花粉管生长缺陷,表明CAP1-EGFP可以作为探针,以指示CAP1的细胞内定位。研究人员发现CAP1具有均匀分布,并且在花粉粒和花粉管的细胞质中不形成明显的丝状结构。这与CAP1充当肌动蛋白单体结合蛋白的事实一致。因此,数据表明CAP1均匀分布在花粉管的细胞质中。
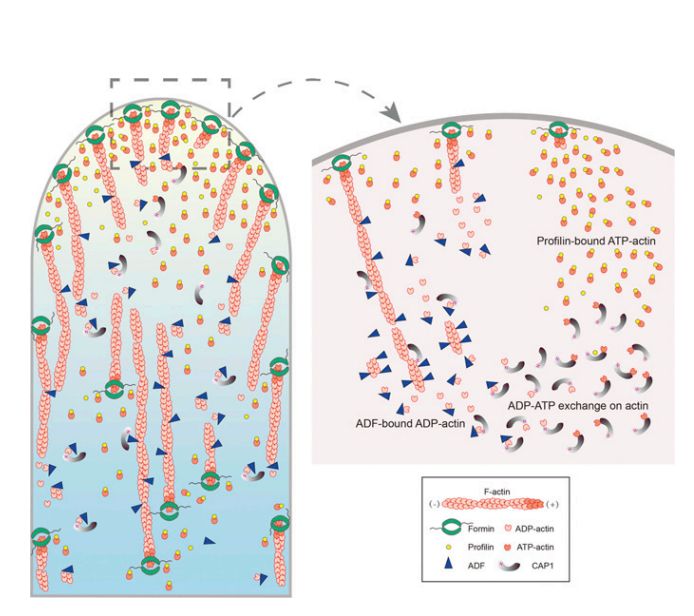
CAP1在花粉管中促进顶端肌动蛋白聚合的作用模型
肌动蛋白聚合驱动快速极化的花粉管生长,但在花粉管生长结构域内肌动蛋白聚合的机制仍未完全了解。该研究在此确定CAP1是驱动肌动蛋白聚合的主要参与者,其通过再充电ADP-G-肌动蛋白并促进以涉及花粉管中CAP1的核苷酸交换活性的方式形成和维持聚合能力的肌动蛋白单体库。 该研究直接将CAP1的肌动蛋白核苷酸交换活性与其促进肌动蛋白聚合的作用联系起来。因此,该研究显着增强了对花粉管中肌动蛋白聚合机制的理解。
原文链接:
https://www.pnas.org/content/early/2019/05/22/1821639116
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247501419&idx=6&sn=8a290753e063589151a1a2998c08c563&chksm=fce6b5b4cb913ca2a3a5c78a262316918322a729fd2d1544bfff19d5ce1b8974b42db103ad28&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn