科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-12
来源:BioArt
原标题:Sci. Transl. Med. | 成功逆转腹膜纤维化,彭辉组揭示腹膜纤维化机制,为腹膜纤维化的治疗开启新思路
腹膜透析(peritoneal dialysis, PD)是终末期肾脏病患者最重要的肾脏替代治疗方式之一, 目前全世界有约15%的终末期肾病患者接受PD治疗【1】。 然而,含有高浓度葡萄糖的腹膜透析液本身可导致腹膜间皮细胞的结构和功能改变,导致腹膜炎症和新生血管的生成,最终引起腹膜纤维化【2】。腹膜纤维化造成的腹膜功能减退和超滤衰竭影响着约50%的长期腹膜透析患者,严重制约了PD治疗的长期应用和患者的预后【3】。 有关腹膜纤维化的发病机理和治疗措施仍然匮乏,也是近 20 年来腹膜透析领域的研究热点和难点【4】。
López-Cabrera M.团队于2003年在新英格兰医学杂志发文,揭示了腹膜透析液可以引起PD患者腹膜间皮细胞向间充质细胞转化,表现为细胞角蛋白(cytokeratins)和E-Cdaherin表达量下降,并且在PD患者的腹膜活检组织中发现,间皮细胞层消失,在间皮下层的纤维组织当中出现I-CAM1染色阳性的间皮细胞,证明了间皮-间充质转化(mesothelial to mesenchymal transition, MMT)是腹膜纤维化发生的重要机制【5】。然而,该机理在动物模型中受到了挑战【6】。
2019年6月5日,中山大学彭晖课题组和贝勒医学院胡兆永课题组合作在Science Translational Medicine发表了题为Inhibition of hyperglycolysis in mesothelial cells prevents peritoneal fibrosis的研究论文,深入研究腹膜透析对患者间皮细胞MMT及腹膜纤维化的作用。

研究者分别采集长时间(超过6年)及短时间(小于2周)PD患者腹膜透析透出液的脱落细胞,共获得 96,446 个细胞进行单细胞转录组测序(single-cell RNA-Seq, scRNA-Seq),发现长时间PD患者的腹膜间皮细胞确实发生MMT。在间皮细胞出现 MMT 并向腹膜纤维化转变的过程中,包括 HK 和 PFK 在内编码糖酵解酶的基因在长时间PD患者的间皮细胞中表达量显著升高,提示间皮细胞在 MMT-纤维化过程中发生了能量代谢重编,显著增强的糖酵解参与介导了 MMT,促进腹膜纤维化的进展。

图1. a-b为PD患者腹膜透析液脱落细胞t-SNE图, 图c为间皮细胞MMT 的Trajectory分析
接下来研究者建立了小鼠腹膜纤维化模型,采用代谢组学结合实时细胞呼吸功能测试,在体内及体外实验验证了间皮细胞过度增强的糖酵解参与了腹膜纤维化,并采用 2-脱氧葡萄糖(2-DG)完全阻断糖酵解证实可以阻止小鼠模型腹膜纤维化的发生。通过对小鼠纤维化的腹膜进行 microRNA microarray 分析,筛选出与糖酵解及纤维化密切相关的 3 个 microRNA, 并以腺相关病毒 (AAV1) 为载体搭载三联 microRNA 治疗腹透模型小鼠,在小鼠体内证实通过抑制腹膜组织异常增高的糖酵解,最终减轻腹膜组织的纤维化。
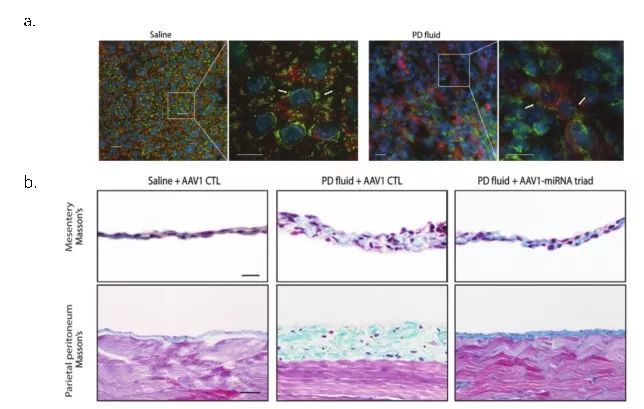
图2. a. 腹膜透析液刺激后,PhaMexcised小鼠腹膜间皮细胞线粒体形态发生显著改变,分裂(fission)增加; b.腺相关病毒搭载的三联miRNA显著改善腹膜透析液引起的小鼠脏层及壁层腹膜的增厚及纤维化
这项研究发现了腹膜透析液通过增强糖酵解引起腹膜间皮细胞能量代谢重编,从而导致间皮细胞MMT和腹膜纤维化的病理机制,这是一种全新的腹膜纤维化发病机制,也是近10年来腹膜透析研究领域的重大进展。同时,该研究首次采用腺相关病毒(AAV1)介导三联miRNA的基因疗法成功治疗了小鼠模型的腹膜纤维化,为AAV1 基因治疗腹膜纤维化提供了理论基础和动物实验证据,为腹膜纤维化的治疗开启了新的思路,有重大的临床转化意义。
原文链接:
https://stm.sciencemag.org/content/11/495/eaav5341
参考文献
1. P. K.-T. Li, K. M. Chow, M. W. M. Van de Luijtgaarden, D. W. Johnson, K. J. Jager, R. Mehrotra, S. Naicker, R. Pecoits-Filho, X. Q. Yu, N. Lameire, Changes in the worldwide epidemiology of peritoneal dialysis., Nat. Rev. Nephrol. 13, 90–103 (2017).
2. L. S. Aroeira, A. Aguilera, J. A. Sanchez-Tomero, M. A. Bajo, G. del Peso, J. A. Jimenez-Heffernan, R. Selgas, M. Lopez-Cabrera, Epithelial to mesenchymal transition and peritoneal membrane failure in peritoneal dialysis patients: pathologic significance and potential therapeutic interventions., J. Am. Soc. Nephrol. 18, 2004–2013 (2007).
3. O. Devuyst, P. J. Margetts, N. Topley, The pathophysiology of the peritoneal membrane., J. Am. Soc. Nephrol. 21, 1077–1085 (2010).
4. A. Pletinck, R. Vanholder, N. Veys, W. Van Biesen, Protecting the peritoneal membrane: factors beyond peritoneal dialysis solutions., Nat. Rev. Nephrol. 8, 542–550 (2012).
5. M. Yanez-Mo, E. Lara-Pezzi, R. Selgas, M. Ramirez-Huesca, C. Dominguez-Jimenez, J. A. Jimenez-Heffernan, A. Aguilera, J. A. Sanchez-Tomero, M. A. Bajo, V. Alvarez, M. A. Castro, G. del Peso, A. Cirujeda, C. Gamallo, F. Sanchez-Madrid, M. Lopez-Cabrera, Peritoneal dialysis and epithelial-to-mesenchymal transition of mesothelial cells., N. Engl. J. Med. 348, 403–413 (2003).
6. Y.-T. Chen, Y.-T. Chang, S.-Y. Pan, Y.-H. Chou, F.-C. Chang, P.-Y. Yeh, Y.-H. Liu, W.-C. Chiang, Y.-M. Chen, K.-D. Wu, T.-J. Tsai, J. S. Duffield, S.-L. Lin, Lineage tracing reveals distinctive fates for mesothelial cells and submesothelial fibroblasts during peritoneal injury., J. Am. Soc. Nephrol. 25, 2847–2858 (2014).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652471188&idx=4&sn=40bd9e4cb971e969f9bbe71b1c29bee1&chksm=84e2ec20b39565363fa5bc6e64074f6815b76a82fc6f48fd9b8073503d36eb019b915e485a95&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn