科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-16
来源:iNature
原标题:Cell Res | 肠道微生物介导的新型信号通路!中科院生物物理所刘志华团队等人发现肠道微生物与胰岛交流的信号通路
肠道共生菌和肠外器官之间的长距离交流可以通过循环细菌信号分子、神经回路或宿主细胞的细胞因子或激素进行。2019年6与14号,中科院生物所刘志华研究团队与中山大学附属第一医院精准医学研究院魏泓研究团队合作在Cell Research上在线发表了Intestinal lysozyme liberates Nod1 ligands from microbes to direct insulin trafficking in pancreatic beta cells的研究论文。该研究报告了由肠道细菌衍生的Nod 1配体作为信号分子,直接调节胰岛β细胞中胰岛素的转运,定义了一种新型的基于循环细菌信号分子的器官间通讯,这对于理解微生物和宿主之间的相互关系有着广泛的意义。

微生物在调节宿主代谢过程中起着至关重要的作用。了解微生物是如何调节宿主代谢的是至关重要的。除了通过帮助消化无法消化的食物成分和生物合成必需的代谢物来帮助消化营养外,微生物还通过与肠道或远距离的肠外器官沟通,在调节宿主代谢方面发挥着重要作用。微生物与宿主器官之间的长距离通讯可以通过循环系统中的微生物信号分子直接通讯,通过神经间接信号传递,或者通过宿主细胞的细胞因子或激素来实现。信号分子可以是微生物、它们分泌的蛋白质或它们的代谢物的结构成分。许多构成肠道微生物与宿主器官之间长期串扰的机制仍有待发现。
肠道微生物定植对宿主代谢有着复杂的影响。细菌的肠道定植与能量收集增加、体脂含量增加和胰岛素敏感性降低有关。例如,在正常微生物区系的成年无菌C57BL/6小鼠体内,尽管摄食量减少,但在14天内就会产生相对胰岛素抵抗。事实上,Nod 1配体能促进胰岛素抵抗,特别是在饮食诱导的肥胖(DIO)小鼠模型中,这一现象被认为是先天免疫激活所致。细菌Nod 1配体除了促进炎症和胰岛素抵抗外,在代谢中是否具有更复杂的作用尚不清楚。
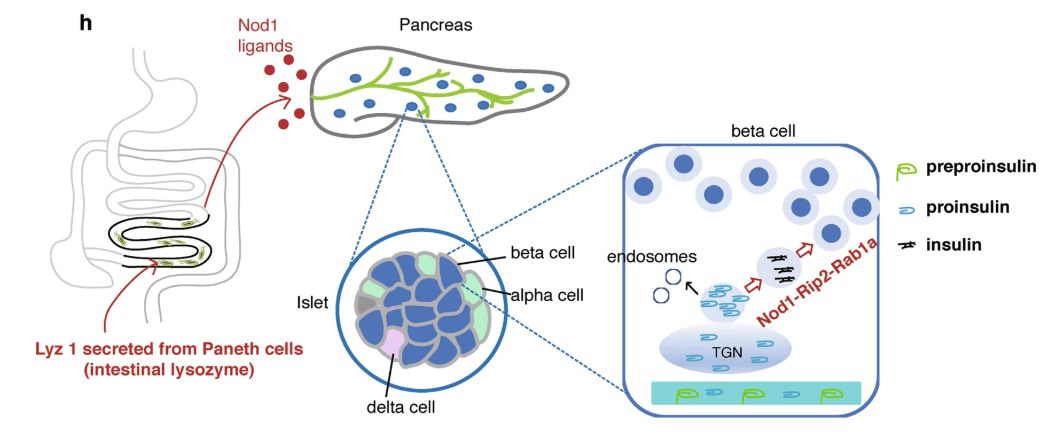
肠 - 胰岛串扰的示意图
在此,研究人员报告了由肠道细菌衍生的Nod 1配体作为信号分子,直接调节胰岛β细胞中胰岛素的转运。胞质肽聚糖受体Nod 1及其下游适配器RIP 2是β细胞以细胞自主方式转运胰岛素所必需的。与此同时,在识别同源配体后,Nod 1和RIP 2定位于胰岛素囊泡,招募Rab1a来指导胰岛素通过细胞质的转运。重要的是,肠溶菌酶将Nod 1配体释放到循环中,从而使肠道微生物与胰岛之间进行长期交流。由Nod 1配体连接的肠-胰岛串扰调节宿主的糖耐量。该研究定义了一种新型的基于循环细菌信号分子的器官间通讯,这对于理解微生物和宿主之间的相互关系有着广泛的意义。
原文链接:
https://www.nature.com/articles/s41422-019-0190-3
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247502067&idx=6&sn=4efc17c37935dcd85a580e6b340285a6&chksm=fce6bb2ccb91323a4da6af3ecfd3e010e0d65d51366b1590f3de82f1fd999c2fbdf01ff4bbfd&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn