科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-27
来源:iNature
巨噬细胞可通过筏/细胞膜内陷和/或网格蛋白依赖性内吞作用内化入侵病原体并引发针对感染的免疫应答。然而,巨噬细胞胞吞作用的分子机制仍然难以捉摸。2019年6月25日,曹雪涛团队在PNAS 在线发表题为“An endosomal LAPF is required for macrophage endocytosis and elimination of bacteria”的研究论文,该研究发现LAPF(含有PH和FYVE结构域的溶酶体相关和凋亡诱导蛋白)是细胞膜内陷介导的内吞作用所必需的。Lapf缺陷型巨噬细胞具有内吞和消除细菌的能力受损。巨噬细胞特异性Lapf缺陷小鼠对大肠杆菌(E.coli)感染更敏感,细菌负荷更高。此外,Lapf缺乏损害TLR4内吞作用,导致TLR-触发的促炎细胞因子的产生减弱。LAPF定位于早期内涵体并与caveolin-1相互作用。酪氨酸激酶Src对LAPF的磷酸化是LAPF-Src- Caveolin复合物形成和内吞作用以及细菌消除所必需的。总的来说,该研究表明LAPF对细菌的内吞作用和诱导炎症反应至关重要,这表明LAPF和Src可能是控制传染病的潜在靶标。
另外,2019年6月18日,曹雪涛团队在Cell Research 在线发表题为“Interferon-inducible cytoplasmic lncLrrc55-AS promotes antiviral innate responses by strengthening IRF3 phosphorylation”的研究论文,该研究鉴定了一种新的细胞质长非编码RNA(lncRNA),lncLrrc55-AS,它驱动正反馈环以促进干扰素调节因子3(IRF3)信号传导和IFN-I产生。
2019年5月10日,中国医学科学院基础医学研究所北京协和医学院基础学院曹雪涛,姜明红等人在Cellular & Molecular Immunology 在线发表题为“E3 ubiquitin ligase RNF170 inhibits innate immune responses by targeting and degrading TLR3 in murine cells”的研究论文,该研究通过免疫沉淀巨噬细胞中的TLR3结合蛋白,将环指蛋白170(RNF170)鉴定为结合TLR3的E3连接酶。RNF170介导K766在TLR3的TIR结构域中的K48连接的多泛素化,并通过蛋白酶体途径促进TLR3的降解。RNF170的遗传缺失在体外和体内选择性地增强TLR3触发的先天免疫应答。 研究结果揭示了RNF170通过促进TLR3降解选择性抑制TLR3触发的先天免疫反应的新作用(点击阅读)。另外,曹雪涛团队在2019年还发表了7篇文章,在免疫领域取得新突破(点击阅读)。

先天免疫细胞检测入侵病原体并发出适当的炎症反应以消除感染。这些细胞表达多种模式识别受体(PRR),如Toll样受体(TLRs),它们可识别病原体相关分子模式(PAMPs)并激活下游信号级联以诱导炎症。 TLR4是一种特异性识别革兰氏阴性菌脂多糖(LPS)的PRR,通过骨髓分化因子88(MyD88)激活NF-κB和丝裂原活化蛋白激酶(MAPK),进而诱导促炎细胞因子的表达。此外,TLR4在识别LPS时被内化到内体中,通过衔接蛋白Toll-IL-1抗性结构域诱导IFN-β(TRIF)和TRAM(TRIF相关衔接子),诱导IRF3依赖性I型IFN产生。然而,先天信号传导诱导有效的先天反应的分子机制需要进一步研究。
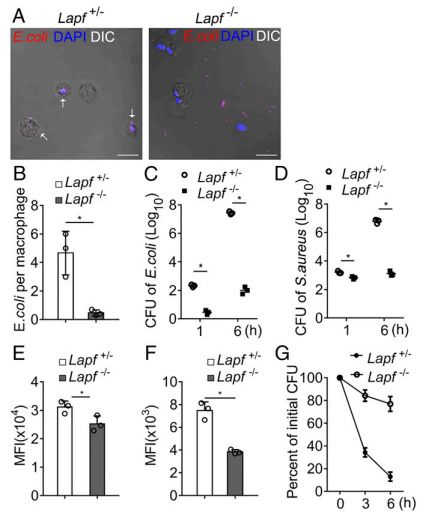
Lapf缺陷型巨噬细胞内吞较少的大肠杆菌和金黄色葡萄球菌,并消除较少内吞的大肠杆菌
先天免疫细胞,例如巨噬细胞,树突细胞(DC),单核细胞和嗜中性粒细胞,可通过内吞作用内化入侵病原体。在内化后,病原体成为从早期内体到溶酶体的细胞器的一系列囊泡运输的靶标,其中它们被Mst1-Mst2-Rac信号传导诱导的活性氧物质(ROS)杀死并随后被水解酶降解。然后将来自这些病原体的抗原呈现在主要组织相容性复合物(MHC)分子上,其随后被T细胞受体识别并激活适应性免疫系统的CD4 +和CD8 + T细胞。内吞作用通过多种机制发生,特别是网格蛋白介导的内吞作用,细胞膜内陷介导的内吞作用,巨胞饮作用和吞噬作用。然而,仍然需要充分研究将入侵病原体的内吞作用与先天信号传导的激活联系起来的机制。
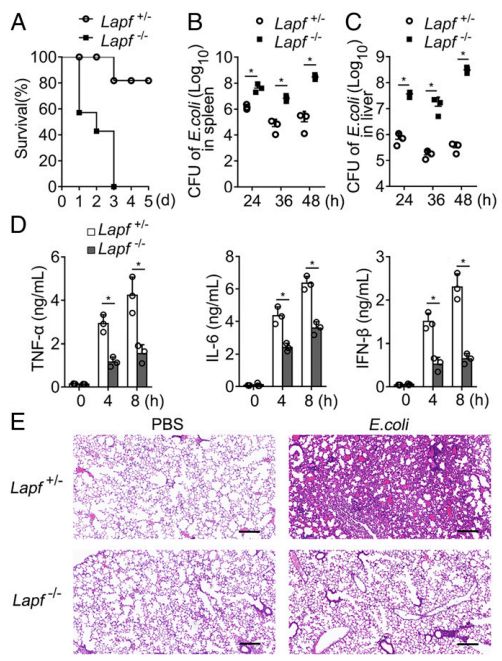
Lapf缺陷型小鼠对大肠杆菌感染更敏感,炎性细胞因子较少
Caveolae是一种专门的脂筏,是20世纪50年代首次描述的球形质膜内陷。从那以后,细胞膜内陷广泛参与许多细胞过程,如内吞作用,转胞吞作用(一种特殊形式的内吞作用),脂质稳态和信号转导。细胞膜内陷也参与受体的内吞作用,如TLR4,这是先天免疫反应和信号转导的必要调节机制。细胞膜内陷的主要成分蛋白质是caveolins和cavins。 Caveolin家族由三个成员组成,即caveolin-1(Cav1),caveolin-2(Cav2)和caveolin-3(Cav3)。 Cav1和Cav2在大多数细胞类型中表达。 Cav3在肌肉细胞中特异性表达。细胞膜内陷中的Cav1结合TLR4,内皮型一氧化氮合酶(eNOS),MAPK,环加氧酶(COX)和整合素信号分子,启动不同的信号通路。然而,Cav1在细菌感染中的先天功能及其潜在机制尚未确定。
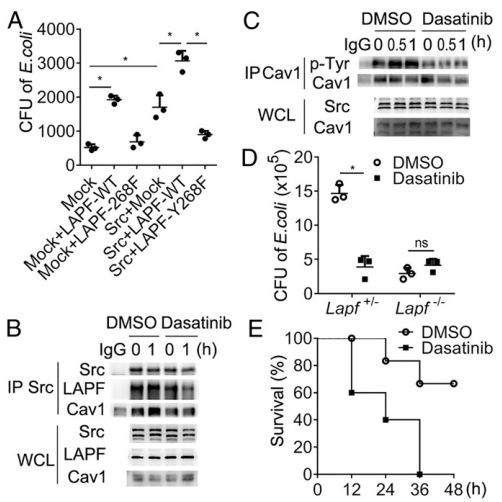
Src-LAPF-Cav1复合物形成的破坏损害了细菌的内吞作用
该研究发现LAPF(含有PH和FYVE结构域的溶酶体相关和凋亡诱导蛋白)是细胞膜内陷介导的内吞作用所必需的。 Lapf缺陷型巨噬细胞具有内吞和消除细菌的能力受损。巨噬细胞特异性Lapf缺陷小鼠对大肠杆菌(E.coli)感染更敏感,细菌负荷更高。此外,Lapf缺乏损害TLR4内吞作用,导致TLR-触发的促炎细胞因子的产生减弱。LAPF定位于早期内涵体并与caveolin-1相互作用。酪氨酸激酶Src对LAPF的磷酸化是LAPF-Src- Caveolin复合物形成和内吞作用以及细菌消除所必需的。总的来说,该研究表明LAPF对细菌的内吞作用和诱导炎症反应至关重要,这表明LAPF和Src可能是控制传染病的潜在靶标。
参考信息:
https://www.pnas.org/content/116/26/12958.long
来源:Plant_ihuman iNature
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3MTE3MjUyOA==&mid=2247502363&idx=5&sn=f2ce58b307d5c05eb68beea8393620b7&chksm=fce6b9c4cb9130d24180017e1cf95b99c34c993dbb6fac1edf13f2edb08681ad7cbf283ac0a0&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

再发Science!曹雪涛团队发表最新研究成果
曹雪涛团队发现细胞核内存在病毒DNA识别分子
研究进展:小泡介导的内吞作用驱动聚合纳米粒子中siRNA向巨噬细胞的递送

“促癌黑手”Ter细胞首次发现
细胞内吞作用

曹雪涛事件进展:《科学》等期刊已开始核查相关论文
中国工程院:将调查曹雪涛“论文造假”事件




工程院院士曹雪涛任南开大学校长
曹雪涛团队Science发文首证细胞还存在别的“攻防系统”




曹雪涛团队《CancerCell》发文揭示肿瘤相关巨噬细胞促进肿瘤的转移和化疗抵抗的新机制