科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-06-28
近10年来,靶向肿瘤代谢异常成为抗肿瘤新药研发领域备受关注的研究方向之一。当前,针对十余个代谢酶靶点的数十个小分子抑制剂正处在临床前和临床研究中。其中,靶向异柠檬酸脱氢酶(Isocitrate dehydrogenase,IDH)突变的抑制剂已经分别于2017年和2019年被美国FDA批准用于携带有IDH2和IDH1突变的急性髓性白血病的治疗,代表了肿瘤代谢抑制剂的率先突破。然而,除IDH抑制剂外,大多数代谢酶抑制剂的治疗获益并不明确,在临床前研究中抗肿瘤效果就差强人意。GLUT1、MCT1、LDHA、FASN等备受关注的代谢靶点,历经多年的探索,尚无药物在临床研究中取得显著突破。 肿瘤的代谢异质性(Metabolic heterogeneity)是造成上述困境的最重要的因素之一。代谢异质性是指不同肿瘤或同一肿瘤组织内部的代谢特征的显著差异,是肿瘤异质性的重要内容,主要受不同基因型或微环境的驱动所致。肿瘤代谢异质性广泛存在;然而,大多数肿瘤代谢抑制剂在抗肿瘤研究时,缺乏敏感群体遴选依据,导致获益甚微。 中国科学院上海药物研究所研究员黄敏近年来致力于探索肿瘤代谢抑制剂研发,前期发现了一系列代谢酶抑制剂及相关的用药方案。在代谢抑制剂研发的过程中,面对代谢抑制剂敏感群体不明的治疗困境,提出了从临床现有的分子分型入手,建立癌基因与代谢依赖性关系的研究策略。与厦门大学教授林树海合作,团队聚焦分子分型清晰的非小细胞肺癌,从受体酪氨酸激酶(Receptor tyrosine kinase,RTK)入手,综合运用多种稳定同位素标记的代谢组学和转录组学技术,阐明了不同RTK驱动肿瘤的代谢依赖性及其转录调控的分子机制,系统证实了EGFR突变和FGFR扩增驱动肿瘤的代谢弱点。其中,EGFR突变肿瘤高度依赖丝氨酸合成通路,而FGFR扩增肿瘤依赖乳酸合成。研究还利用人源肿瘤组织来源移植瘤PDX模型,证实了EGFR突变和FGFR扩增作为丝氨酸代谢和乳酸合成抑制剂敏感标志物的可行性,为同类代谢抑制剂的个性化治疗提供了重要信息,为代谢抑制剂敏感群体研究提供了新的思路。 上述工作于6月20日以Identification of metabolic vulnerabilities of receptor tyrosine kinases-driven cancer 为题,发表于《自然-通讯》(Nature Communications)杂志。该研究得到科技部港澳台科技国际合作专项、国家自然科学基金委创新研究群体项目和中科院战略性先导科技专项(A类)等的大力支持。 论文链接 FGFR和EGFR驱动的代谢依赖性
内容来源:中国科学院
来源:中国科学院
原文链接:http://www.cas.cn/syky/201906/t20190627_4697185.shtml
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Science Advances│王红霞团队研究揭示乳腺癌循环肿瘤细胞异质性
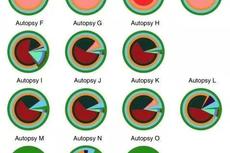
Nat Med:液体和组织活检检测胃肠道肿瘤的获得性耐药和肿瘤异质性
通过单细胞测序技术揭示肝胆肿瘤异质性

广州健康院在提升CAR-T细胞抗异质性肿瘤活性方面取得新进展

Cell: 肿瘤内的异质性才是决定肿瘤免疫反应的关键
【新科技知识干部读本】海洋药物研究有利于新药研发

中科院等科学家合作研究揭示胰腺癌肿瘤-微环境高度异质性细胞特征

2020 CCO | 主旨报告-雷群英:代谢异质性—肿瘤发生发展的幕后之手
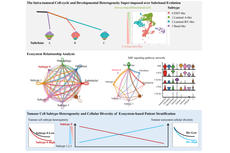
研究揭示前列腺癌亚克隆演化与肿瘤转录异质性的关联

【学术前沿】贝锦新/曾益新/张泽民联合解析鼻咽癌异质性和肿瘤微环境复杂网络