科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-02
来源:中国生物物理学会
责编 ∣王相宜
2019年6月25日,《PNAS》杂志在线发表了胡俊杰课题组的研究论文“Atlastin-mediated membrane tethering is critical for cargo mobility and exit from the endoplasmic reticulum”。 本研究中发现内质网膜融合蛋白atlastin(ATL)参与调节内质网中蛋白的流动性及膜转运,为管状内质网的功能阐明提供了新的依据。
真核细胞中的内质网是由连续的片状和管状结构组成的复杂网络,纵横交错的管状网络主要由两组富集于管状内质网的膜蛋白来维持:Reticulons 和REEPs可以诱导产生并稳定膜曲度,使生物膜形成管状结构;dynamin超家族蛋白 ATL则通过介导膜融合促进内质网管状网络的构建。细胞中ATL的缺失或突变会导致内质网产生长而不分枝的管状结构,ATL1的突变在人体内会引起遗传性痉挛性截瘫(HSP)。胡俊杰研究组近几年的研究成果揭示了ATL及其同源蛋白Sey1p和RHD3介导内质网同源膜融合的分子机制,而内质网管状网络在细胞生命活动中行使的具体生理功能及作用机制仍不清楚。
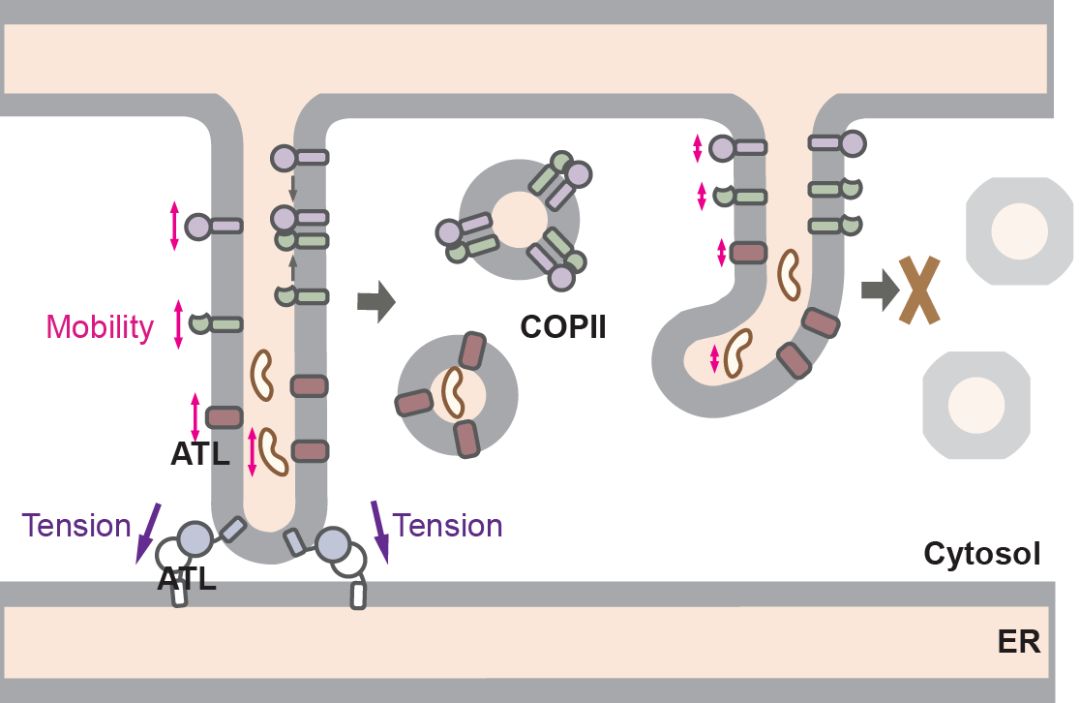
图示:ATL调节COPII形成的模式图
供稿:中科院生物物理所胡俊杰课题组
内质网中合成的分泌蛋白和其他内膜系统的膜蛋白在经过折叠修饰后,需要通过COPII (coat protein II) 包被的囊泡运往高尔基体。本研究发现ATL敲除的细胞中,外周COPII的形成显著减少,货物蛋白从内质网的输出被延迟。内质网输出位点(ER exit sites,ERESs)的行成和分布并不受到ATLs缺失的影响,但是很多输出位点不能进一步招募COPII衣被蛋白。半通透细胞的COPII出芽实验显示,内质网中缺失ATLs或内质网被瞬时片段化时,COPII货物蛋白的包装效率都会明显降低,而不同的货物会受到不同程度的影响。进一步研究发现ATL的缺失会降低货物蛋白在内质网中的流动性。有趣的是,不能介导融合但可以部分实现膜拴连的ATL1 R77A突变体在缺失了ATLs的细胞中表达时,虽不能完全恢复内质网的形态,却足以恢复蛋白的流动性和COPII的形成。这些发现表明,内质网膜的拴连对于调控内质网中的物质流动,以及COPII货物蛋白的有效包装起着至关重要的作用。有报道显示,膜的侧向张力对膜的流动性有很大影响,而膜拴连恰恰能起到维持膜侧向张力的效果。
该工作由中国科学院生物物理研究所及香港科技大学合作完成。生物物理研究所胡俊杰研究员和香港科技大学郭玉松教授为本文的共同通讯作者,胡俊杰课题组的牛丽灵和郭玉松课题组的马天骥为本文的并列第一作者。该研究得到国家自然科学基金,国家重点研发计划和中国科学院战略性先导科技专项(培育项目)的支持。
文章链接:https://www.pnas.org/content/early/2019/06/24/1908409116


中国生物物理学会官方订阅号,为BSC会员及生物物理领域专业人士服务。
投稿及授权请联系:bscoffice@bsc.org.cn。
微信号:BSC-1979

来源:BSC-1979 中国生物物理学会
原文链接:http://mp.weixin.qq.com/s?__biz=MzA4NjE1NTQ5Mg==&mid=2649498612&idx=2&sn=a70b4f82679ef43dba40bf328470a0d1&chksm=87d58a7fb0a20369330ecbdf29011883a39589052e041ce276e795212e2a40fd052d48579e9e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
汉坦病毒表面糖蛋白晶格及其融合调控机制

生物物理所等揭示内质网融合蛋白调控膜转运的分子机制
【科技前沿】胡俊杰课题组发现调控脂滴新生的新机制

饶子和与胡俊杰课题组在线粒体内膜融合研究方面再获新进展

【科技前沿】胡俊杰团队揭示片状内质网形成的分子机制
研究揭示绵羊精卵融合关键蛋白表达规律

饶子和和胡俊杰课题组合作揭示细菌发动蛋白IniA 调控结核耐药的新机制

中国科学家首揭灵长类动物发育和寿命调控的关键通路

高嵩和胡俊杰总结线粒体融合机制的最新研究进展
层状氮化物MNCl (M: Hf, Zr)中电场诱导的稳态超导电性