科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-10
来源:BioArt
Rab GTPases是囊泡介导的膜运输中主要调节因子,调节内吞和胞吐的几乎整个运输过程【1】。Rab GTPases的功能受到非活性GDP结合状态和活性GTP结合状态之间的循环调节,这两种状态受两种调节因子的控制:(1)鸟嘌呤核苷酸交换因子(GEF)可释放与Rabs结合的GDP;(2)GTP酶活化蛋白(GAP),其促进与Rab结合的GTP的水解速率。在GDP结合状态下,GDP解离抑制剂可从膜中释放Rab GTP酶,调节细胞质中的Rab表达并募集到正确的亚细胞位置。在GTP结合状态下,Rab GTPases可以结合不同的下游效应器,以确保适当的囊泡运动【2】。
最近的研究表明,含有Tre2-Bub2-Cdc16(TBC)结构域的蛋白质是Rab GTPases的特异性GAP【3】。已有研究表明一些TBC蛋白作用于特定的Rab并且调节与它们各自靶Rabs特异的运输和细胞过程【4-7】。
G蛋白偶联受体(GPCR)调节多种生理和病理功能,是市场上约三分之一药物的靶点【8】。对于大多数GPCR,质膜是最重要的功能目的地,其中它们与各自配体结合并激活同源异三聚体G蛋白和其他信号蛋白,进而激活下游效应子。然而,与广泛研究的内化,再循环和降解途径【9】相比,新生GPCR顺行转运至质膜的分子机制即从合成场所——内质网(ER)通过高尔基体到完全成熟的状态,仍然知之甚少。
虽然已经对许多Rab GTPase进行了研究,发现其调节许多GPCR的细胞表面转运、内化、再循环、降解和核转位【10,11】。然而,目前尚不清楚TBC蛋白在GPCR超家族的运输过程中的功能。
2019年7月9日,美国奥古斯塔大学吴光玉教授团队在Cell Reports杂志上发表文章Specific TBC Domain-Containing Proteins Control the ER-Golgi-Plasma Membrane Trafficking of GPCRs。在这项研究中,研究人员确定了六种TBC蛋白可调节GPCR成员的顺行ER-高尔基体-细胞表面转运过程。研究人员还发现TBC1D6通过失活Rab26并抑制Rab26与受体的相互作用来控制GPCR的高尔基体后转运。这些结果揭示了先前未被认可的TBC蛋白的功能,扩展了对GPCR超家族的研究。

G蛋白偶联受体 (GPCRs) 是细胞表面信号蛋白中最大的超家族。然而,对其合成后细胞表面传递的分子机制仍知之甚少。在这里,作者们筛选在GPCRs的细胞内运输中含有TBC结构域的蛋白质,鉴定处六种TBC蛋白TBC1D5, TBC1D6, TBC1D8B, TBC1D20, TBC1D22A和RN-tre,它们在不影响其它细胞膜蛋白的情况下,在从内质网到高尔基体或从高尔基体到细胞膜表面的过程中,调节GPCR的转运。
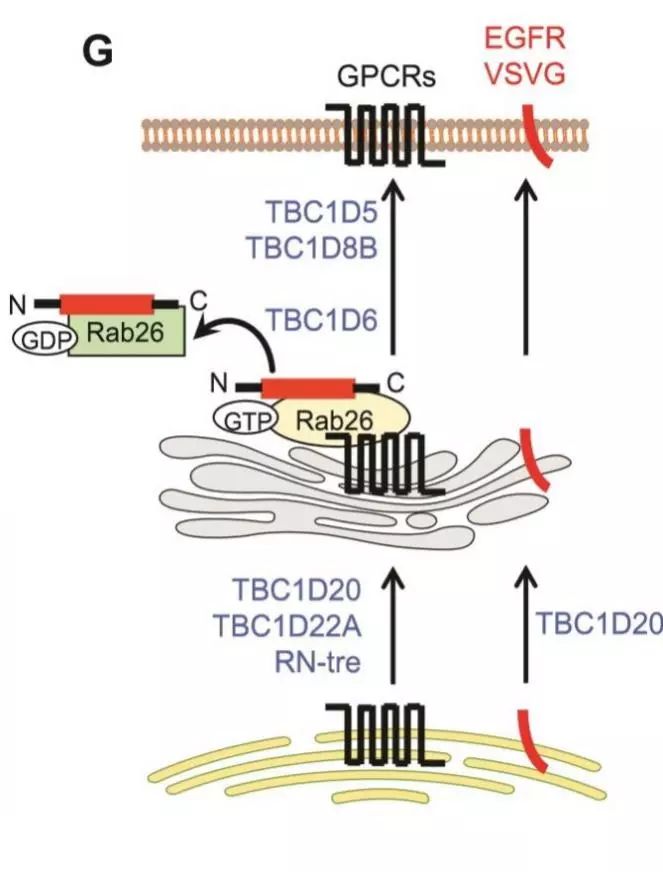
研究表明TBC1D6作为Rab26的GAP,与Rab26结合,减弱了Rab26与GPCRs的相互作用。此外,TBC1D6的过表达和低表达都抑制GPCRs的后高尔基转运。这些数据说明了TBC蛋白在新生GPCRs细胞内正向转运中的重要作用,揭示了GPCRs功能靶点的调控机制。
据悉,吴光玉教授研究组的Zhe Wei,张茂祥(Maoxiang Zhang),Chunman Li是该论文的共同第一作者,吴光玉教授为通讯作者。
原文链接:
https://doi.org/10.1016/j.celrep.2019.05.033
制版人:珂
参考文献
[1] Stenmark, H. (2009). Rab GTPases as coordinators of vesicle traffic. Nat Rev Mol Cell Biol 10, 513525.
[2] Grosshans, B.L., Ortiz, D., and Novick, P. (2006). Rabs and their effectors: achieving specificity in membrane traffic. Proc Natl Acad Sci U S A 103, 11821-11827
[3] Barr, F., and Lambright, D.G. (2010). Rab GEFs and GAPs. Curr Opin Cell Biol 22, 461-470.
[4] Davey, J.R., Humphrey, S.J., Junutula, J.R., Mishra, A.K., Lambright, D.G., James, D.E., and Stockli, J. (2012). TBC1D13 is a RAB35 specific GAP that plays an important role in GLUT4 trafficking in adipocytes. Traffic 13, 1429-1441.
[5] Fuchs, E., Haas, A.K., Spooner, R.A., Yoshimura, S., Lord, J.M., and Barr, F.A. (2007). Specific Rab GTPase-activating proteins define the Shiga toxin and epidermal growth factor uptake pathways. J Cell Biol177, 1133-1143.
[6] Goueli, B.S., Powell, M.B., Finger, E.C., and Pfeffer, S.R. (2012). TBC1D16 is a Rab4A GTPase activating protein that regulates receptor recycling and EGF receptor signaling. Proc Natl Acad Sci U S A 109, 15787-15792.
[7] Haas, A.K., Fuchs, E., Kopajtich, R., and Barr, F.A. (2005). A GTPase-activating protein controls Rab5 function in endocytic trafficking. Nat Cell Biol 7, 887-893. Haas, A.K., Yoshimura, S., Stephens, D.J., Preisinger, C., Fuchs, E., and
[8] Hauser, A.S., Attwood, M.M., Rask-Andersen, M., Schioth, H.B., and Gloriam, D.E. (2017). Trends in GPCR drug discovery: new agents, targets and indications. Nat Rev Drug Discov 16, 829-842.
[9] Hanyaloglu, A.C., and von Zastrow, M. (2008). Regulation of GPCRs by endocytic membrane trafficking and its potential implications. Annu Rev Pharmacol Toxicol 48, 537-568.
[10] Bhosle, V.K., Rivera, J.C., Zhou, T.E., Omri, S., Sanchez, M., Hamel, D., Zhu, T., Rouget, R., Rabea, A.A., Hou, X., et al. (2016).
[11] Dale, L.B., Seachrist, J.L., Babwah, A.V., and Ferguson, S.S. (2004). Regulation of angiotensin II type 1A receptor intracellular retention, degradation, and recycling by Rab5, Rab7, and Rab11 GTPases. J Biol Chem 279, 13110-13118.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472353&idx=6&sn=db1f7cb492e7dd6ce2a5afebf972dd5d&chksm=84e21795b3959e8329663fd07a90f55010c38a9ad58e5a5a1b8dd229fd1ec4ef92151361a0f2&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
中科院科学家研究揭示高尔基体膜蛋白PAQR11对脂代谢和免疫调控新功能

【分析】近红外原位成像脑部高尔基体的极性变化指示小鼠的抑郁程度
激发主动性让纳米药在肿瘤内“潜”的更远、从里到外杀灭肿瘤
研究揭示高尔基体膜蛋白PAQR11对脂代谢和免疫调控新功能
组装细菌“大杀器”免疫系统避免“走火”有绝招

研究揭示高尔基体膜蛋白PAQR11对脂代谢和免疫调控新功能
交大团队揭示核PTEN发挥肿瘤抑制作用新机制:调控RNA剪接影响高尔基体
【学术前沿】贾顺姬/李栋团队合作揭示高尔基体来源小泡调控内吞体分裂

新机制将纳米药“快递”到每个肿瘤细胞
胰腺癌治疗新思路!通过干扰细胞的pH微平衡来杀灭胰腺癌细胞