科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-11
来源:BioArt
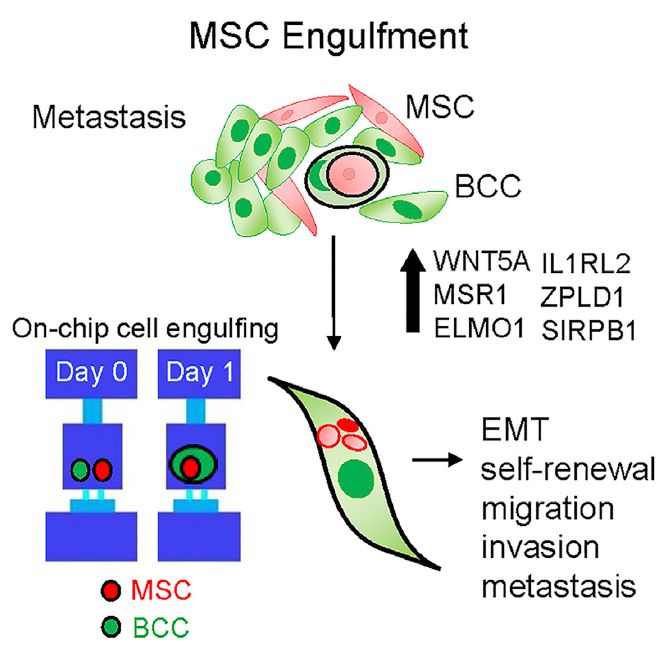
癌症转移 (metastasis) 是乳腺癌最重要的致死原因。癌细胞一旦转移,几乎难以治愈,但转移是一个非常复杂的过程。有研究表明,在癌细胞转移过程中,一种名为间充质干细胞 (mesenchymal stem cell, MSC) 的体细胞会被癌细胞吸引到肿瘤附近,并起到促进肿瘤发育及转移的作用【1】。然而,癌细胞是如何利用MSC细胞协助自身转移的,仍有争议。近年来病理学家观察到少数癌细胞有吞噬体细胞的现象,猜测吞噬现象 (engulfment) 可能与癌症转移有关【2,3】,但由于缺乏精准可靠的实验方法,难以证实并量化吞噬现象的影响。
癌细胞的吞噬现象相对罕见,传统方法可以定性观察,但难以进行量化分析。近年来不断发展的微流体芯片 (microfluidic chip) 研究方法【4】,非常适合精确操纵单细胞并进行高通量分析,因而大量应用于生物学研究中。
近日,密西根大学安娜堡分校Celina G. Kleer团队在Cell Reports杂志上发表文章Mesenchymal Stem/Stromal Cell Engulfment Reveals Metastatic Advantage in Breast Cancer 。

在本研究中,作者开发了一种高通量微流体芯片,实现了大规模的癌细胞-MSC细胞配对与培养,首次观察到癌细胞吞噬MSC细胞的完整过程,并且通过量化分析多个乳腺癌细胞系的吞噬行为,发现良性细胞系几乎不发生吞噬现象,而恶性细胞系中有4-6%会吞噬MSC细胞,证实吞噬行为是恶性癌细胞系的重要特征。

视频. 癌细胞吞噬MSCs
有趣的是,即使在恶性癌细胞系中,仍有相当比例的癌细胞没有吞噬行为。为了进一步探索吞噬现象与癌症转移的关系,作者利用微流体方法,完整地提取出具有吞噬性的癌细胞【5】,并将这些单细胞分别培养成细胞系。通过细胞行为学的体外实验,作者发现,相比于原本的恶性癌细胞系,这些吞噬性细胞系更容易快速迁移 (migration) ,具有更强的侵略性 (invasion) 及干性 (stemness) 。在动物实验中,作者也发现吞噬性细胞系具有更强的转移能力,能够在小鼠体内形成更大的肿瘤组织。
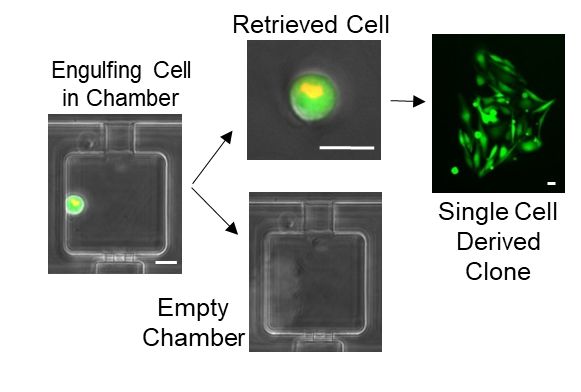
通过进一步的全转录组分析 (whole transcriptome analysis) 实验,作者筛选出了控制吞噬行为的关键基因,并且发现这些基因与已知的人类乳腺癌致癌基因有相当程度的重合。这些关键基因有望成为未来癌症诊断及治疗的标靶,而本研究中所开发的高通量微流体芯片也可望用于预测乳腺癌肿瘤的转移概率。
来自密西根大学安娜堡分校的Dr. Yu-Chih Chen 和 Dr. Maria E. Gonzalez为该论文的共同第一作者,Dr. Celina G. Kleer为通讯作者。
原文链接:
https://www.cell.com/cell-reports/fulltext/S2211-1247(19)30723-5?
参考文献
[1] Berger L. Shamai Y. Skorecki K. Tzukerman M. Tumor specific recruitment and reprogramming of mesenchymal stem cells in tumorigenesis. Stem Cells. 2016; 34: 1011-1026.
[2] Almeida S.M. Rotta I. Cerebrospinal fluid cell cannibalism in metastatic breast adenocarcinoma. Arq. Neuropsiquiatr. 2015; 73: 469.
[3] Bartosh T.J. Ullah M. Zeitouni S. Beaver J. Prockop D.J. Cancer cells enter dormancy after cannibalizing mesenchymal stem/stromal cells (MSCs). Proc. Natl. Acad. Sci. U S A. 2016; 113: E6447-E6456.
[4] Cheng Y.H. Chen Y.C. Brien R. Yoon E. Scaling and automation of a high-throughput single-cell-derived tumor sphere assay chip. Lab Chip. 2016; 16: 3708-3717.
[5] Chen Y.C. Baac H.W. Lee K.T. Fouladdel S. Teichert K. Ok J.G. Cheng Y.H. Ingram P.N. Hart A.J. Azizi E. et al. Selective photomechanical detachment and retrieval of divided sister cells from enclosed microfluidics for downstream analyses. ACS Nano. 2017; 11: 4660-4668
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472384&idx=6&sn=e527000812366c3938c3508f25f07e6d&chksm=84e217f4b3959ee2ba195dda1e593e3d8a91a8b1ef4ce63d7a0a8a52407093a31fa5c499213f&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
第22届全国肿瘤防治宣传周启动仪式在北京举行




靠不吃“饿死”癌细胞?癌症患者补品食用指南来了

靠不吃“饿死”癌细胞?癌症患者补品食用指南来了
癌细胞“天线”如何影响癌症治疗效果
哈佛大学医学院Kucherlapati教授访问中国抗癌协会


新研究发现癌细胞“天线”如何影响癌症治疗效果

新型癌症疗法:关闭癌细胞里的发电站!
Nature癌症新发现:癌细胞能“传染”附近健康细胞

生物学家成功使癌细胞变成正常细胞!癌症有救了?
癌细胞煮豆燃萁:或为癌症治疗提供新思路