科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-12
来源:BioArt
每个人体细胞里有超过十万个以上的增强子,但是在每种体细胞中只有一小部分增强子是激活的,或者说是具有增强基因转录的功能。更加复杂的是不同的体细胞或同一细胞在发育的不同时期,其内部的激活增强子的数目和组合都是不一样的或动态变化的。人类的很多疾病包括肿瘤的发生及其恶化都是与增强子的活性调控失常从而导致基因表达失调相关,所以研究增强子的激活机制对我们了解人类疾病以及寻找新的检测方法和药物靶点是至关重要的!
增强子的DNA位点主要是由转录因子(transcription factor)识别并在上面形成转录激活复合体,而且增强子的激活会伴随着在增强子区域表达出非编码RNA(eRNA)【1】。通过研究最近几年所出现的大量对各种转录因子的全基因组结合位点的高通量测序(ChIP-seq)结果,人们发现在很多细胞内都有大约一千到两千的增强子位点是各种转录因子的结合热点 (hotspot)【2-8】,而且这些转录因子结合热点一般都是各种细胞里最活跃的增强子。在增强子结合热点上,所结合的转录因子大致分为两类:一类是和染色体DNA直接结合;一类是通过蛋白-蛋白相互作用被招募到增强子上。我们把这种转录因子在增强子上的复杂相互作用现象称为MegaTrans【4】。更加有意思的是这些相互作用的各种转录因子受控于不同信号通路,预示着不同信号通路有可能通过其各自所调控的转录因子在这些增强子结合热点上的互作来共同影响基因表达。当然这些猜测还需要更多的研究来证明!
雌激素受体(Estrogen Receptor,ER)信号通路在乳腺癌等多种肿瘤的形成与恶化过程中发挥着重要的作用。因此,ER信号通路调节机制的研究对于乳腺癌的发病机制的深入理解以及潜在临床应用的开发有着重大的意义。以前的研究已经证明ER主要通过结合在基因组的增强子区域来调节ER信号通路下游基因的表达。然而,ER在增强子区域的结合同时需要多种转录因子(包括MegaTrans transcription factor)和各种表观遗传辅因子(co-factor)的共同协作【4】,表明ER在对增强子区域的识别与结合过程中是由多种因子参与,层次分明的复杂机制调控,而我们对于这个复杂机制中的关键过程和关键因子还缺乏详细的认识。所以研究ER增强子转录激活复合体的形成和结构对我们了解乳腺癌肿瘤的形成与恶化过程非常作用。
2019年7月11日, 美国德克萨斯大学健康医学中心圣安东尼奥分校(UT Health Science Center at San Antonio)刘志杰、陈丽珍联合课题组于Molecular Cell期刊发表题为A non-canonical role of YAP/TEAD is required for activation of estrogen-regulated enhancers in breast cancer的研究论文。该研究工作发现在ER阳性乳腺癌细胞中,Hippo信号通路的关键核因子YAP和TEAD可以与ERα相互作用,从而促进ERα在其结合的增强子区域形成转录激活所需要的复合体,特别是促进ERα在增强子上对Mediator MED1的募集。YAP/TEAD和ERα的这种互作也是增强子非编码RNA(eRNA)转录的前提条件。所以YAP/TEAD和ERα在增强子上的互作影响了增强子的激活从而调控了ER信号通路下游基因的表达。上述结果揭示了ERα增强子的活性受到多种不同信号通路核因子通过互作而达到的共同调节,为寻找ER阳性乳腺癌的治疗靶点提供了新的思路。

研究人员利用邻近生物素标记蛋白质组学方法(BioID-MS)在ER阳性乳腺癌细胞株中检测到YAP/TEAD在细胞核内与ERα发生相互作用。ChIP-seq表明YAP/TEAD除了结合在经典的Hippo信号通路下游基因的靶点上(经典结合点),在雌激素的刺激下YAP/TEAD还同时结合在ERα增强子区域(非经典结合点)。后续的YAP/TEAD的敲低实验进一步证明,YAP/TEAD通过促进ERα对MED1在增强子的募集来调节ERα增强子的活性。YAP/TEAD的敲低也同时降低了增强子上的eRNA和下游基因的表达水平。此外,值得注意的是,虽然TEAD4有独立的DNA结合域(DNA-binding domain,DBD)来结合经典结合点,课题组通过对TEAD4的DBD诱导突变证明了TEAD4是通过与ERα的蛋白-蛋白相互作用来结合在ERα增强子区域上的。因为TEAD4自身的DBD突变只会影响TEAD4结合经典结合点(Hippo信号通路下游基因),但是对TEAD4结合非经典结合点(ERα增强子区域)没有影响。同时,课题组利用in vitro细胞模型和in vivo xenograft小鼠模型也明确了YAP和TEAD在雌激素依赖的肿瘤生长中的重要性。
该研究成果揭示了YAP/TEAD在ERα增强子活性调节中的重要作用。这一结果不但表明了ER信号通路在转录水平的调节由多种因子协作共同完成,而且TEAD4通过与ERα的蛋白-蛋白相互作用结合在增强子的现象也表明了不同转录因子间协作的多样性。这些都将有助我们更深入了解转录因子的结合热点(hotspot)和MegaTrans的复杂现象。在此项研究的基础上,将来的研究工作将着眼于进一步明确ERα 增强子调节机制的不同层级以及各层级中的关键因子,为乳腺癌的临床治疗提供新的药物靶点及思路。
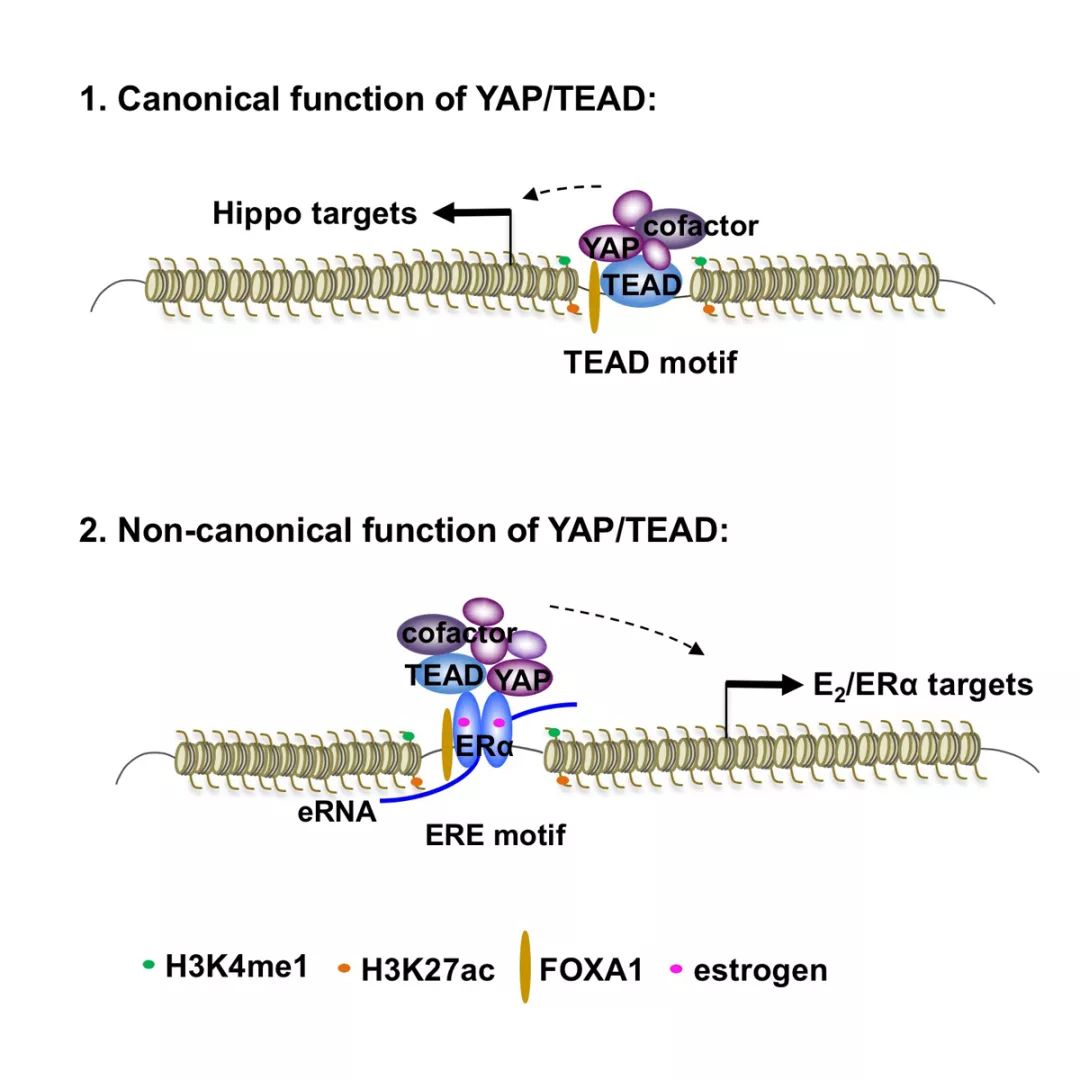
Hippo信号通路在生物个体发育特别是组织器官大小调控过程中具有关键功能,同时在肿瘤发生及迁移过程中发挥十分重要的作用,但是过去几年大量研究集中在了解该通路的经典功能上面。刘志杰/陈丽珍课题组对YAP/TEAD非经典功能的新发现说明Hippo信号通路的作用机制比我们想象的要更加复杂的多,所以以后的研究思路应该要同时考虑经典功能和非经典功能。
据悉,本项研究由得克萨斯大学健康医学中心刘志杰助理教授主持完成,陈丽珍为共同通讯作者,朱赤、李丽、张钊以及毕明君博士为共同第一作者。
原文链接:
https://doi.org/10.1016/j.celrep.2019.06.017
参考文献
1. Li, W. et al. Functional roles of enhancer RNAs for oestrogen-dependent transcriptional activation. Nature 498, 516-520 (2013).
2. Boija, A. et al. Transcription Factors Activate Genes through the Phase-Separation Capacity of Their Activation Domains. Cell 175, 1842-1855 e1816 (2018).
3. Junion, G. et al. A transcription factor collective defines cardiac cell fate and reflects lineage history. Cell 148, 473-486 (2012).
4. Liu, Z. et al. Enhancer activation requires trans-recruitment of a mega transcription factor complex. Cell 159, 358-373 (2014).
5. Siersbaek, R. et al. Molecular Architecture of Transcription Factor Hotspots in Early Adipogenesis. Cell reports (2014).
6. Siersbaek, R. et al. Transcription Factor Cooperativity in Early Adipogenic Hotspots and Super-Enhancers. Cell reports (2014).
7. Wilson, N.K. et al. Combinatorial transcriptional control in blood stem/progenitor cells: genome-wide analysis of ten major transcriptional regulators. Cell stem cell 7, 532-544 (2010).
8. Yan, J. et al. Transcription factor binding in human cells occurs in dense clusters formed around cohesin anchor sites. Cell 154, 801-813 (2013).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652472429&idx=3&sn=cb217033dbccc4f86537063fbd5fc81c&chksm=84e217d9b3959ecf180b2a89c38f5e27feb5be728e4b14ff8fc5f746ecf4b3bf551d98ecba6a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

负面情感信号经两条通路影响行为

大型衰老相关基因表达谱数据库建成

首次发现博卡病毒能调控NF-κB信号通路

一文捋清 Wnt 信号通路与神经炎症(附完整 Wnt 通路图谱)

从一篇10+文章看反义lncRNA如何调控基因表达
我国科学家首次系统揭示人类消化道发育细胞图谱
单细胞cAMP信号通路调控的光遗传学工具

靶向 TNF/TNFR 信号通路的药物及其机制研究

新突破│小脑奥秘知多少:单细胞基因表达谱揭示小脑细胞分化机制

Cell亮点 丨胰岛素受体调控基因表达的新方式