科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-07-20
来源:药学进展
专家介绍:陈填烽

暨南大学化学与材料学院教授(博导)、副院长、暨南大学附属第一医院纳米诊疗研究所所长,担任第六届国际硒研讨会主席、广东省纳米化学创新药物工程技术研究中心主任。一直致力于纳米化学创新药物的功能设计与肿瘤诊疗应用研究,获得万人计划青年拔尖人才项目、国家863计划、国家自然科学基金项目等多个项目的资助。先后入选了新世纪优秀人才支持计划(2010年)、国家863青年科学家(2013年)、广东省杰出青年基金项目(2013年)、霍英东青年教师奖(2014年)及万人计划青年拔尖人才(2015年)。近5年以通讯作者在AngewChemIntEd、AdvFunctMater及ACSNano等本领域主流杂志发表关于硒的研究论文超过200篇,其中杂志封面论文30篇, H指数 48,申报中国专利50项,授权美国专利1项,实现技术成果转化8项。以第一完成人获得2018年中华医学科技奖青年科技奖、2018年广东省自然科学二等奖、2017年中国产学研创新奖、2015年广州市科技二等奖、2016年首届中国创新大赛优秀奖、2014年第三届金博奖及2012年第七届国际发明展览会银奖。目前担任中国抗癌协会青年理事会理事、中国抗癌协会纳米肿瘤学专业委员会青年委员及广东省化学会化学生物学专业委员会副主任,同时担任ChineseChemLett青年编委。
正文
冰片及其纳米化制剂的生物医药应用进展
[摘要]冰片作为传统中药在抗炎镇痛方面具有重要调控作用,同时由于其具有强大的促透作用,从而可提高药物的血药浓度和生物利用度,因此在食品工业和医药工业应用非常广泛。综述冰片在抗炎、镇痛、神经元保护、促透作用、化疗增敏及其促进纳米药物吸收与递送和剂型改造方面的应用进展。
一直以来,冰片素有“引药上行”和“佐使有功”的功能,因此其常作为佐使药被广泛应用。由于冰片具有促进不溶性药物透皮吸收以及可提高其他药物的血药浓度和生物利用度等作用,其在食品和医药工业应用非常广泛,是双料喉风散、复方丹参滴丸、速效救心丸、麝香保心丸、复方丹参片、心血宁片等60多种名优中成药的主要成分,起着“药引”的作用,以增加其他药物的治疗效果。目前,冰片按其来源可分为左旋冰片、右旋冰片和合成冰片,由于它们的旋光性差异,其生物学功能及安全性也存在区别,因此,如何区分冰片旋光性及生物学效应,对于更好地掌握冰片的临床应用,消除安全隐患具有重要意义。近年来,随着人们对冰片认识的深入,冰片在抗炎、镇痛、神经元保护、促透作用、化疗增敏以及冰片剂型改造等方面应用广泛。本文就冰片及其纳米化制剂的生物医药应用进展进行综述,以期为相关药物的研发提供参考。
1冰片的旋光性及其生物效应
冰片又称龙脑和梅片,分为天然冰片和合成冰片,天然冰片又细分为天然左旋冰片(化合物1)和天然右旋冰片(化合物2)。天然右旋冰片主要来源于龙脑香科植物龙脑香树树脂和梅片树枝叶中提取的天然结晶性化合物,其比旋度为+34°~+38°。天然左旋冰片则由菊科多年生草本植物艾纳香叶的升华物经加工而成,其比旋度为-36.5°~-38.5°。合成冰片又称异冰片(化合物3),则是利用松节油中的α-蒎烯与脱水草酸为原料经过化学方法合成而得,其含左旋龙脑、右旋龙脑以及樟脑成分,因此,合成冰片是消旋体。这3种冰片是旋光异构体,由于其结构中甲基以及羟基官能团位置的差异导致各自的生物学活性有所区别,同时由于其来源不同,所含杂质、副产物也有差别,因此,所产生不良反应也不同。
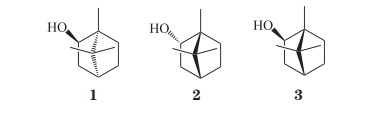
虽然2010版中国药典已对合成冰片、右旋冰片及左旋冰片中的冰片含量做了规定,但是由于合成冰片中的右旋冰片含量一般仅达55%,其中的其他成分如樟脑对人体有很强的副作用,也容易引发过敏等反应,因此,合成冰片与天然冰片相比在功效上会有一定差距。早在1986年,徐连英等就合成冰片对小鼠生育作用进行研究,结果发现,经合成冰片给药后,中、晚期妊娠小鼠发生了流产现象,提示其存在致流产副作用。胡利民等以Wistar大鼠为模型,考察天然右旋冰片以及合成冰片对胃黏膜屏障的影响,结果显示,在空腹情况下给予0.2g·kg-1的合成冰片时能够显著降低胃黏膜电位以及黏膜血流,而同等剂量下的天然冰片则无此现象。同样的,陆洋等以蛙皮为体外模型,考察了天然冰片和合成冰片对栀子提取物黏膜通透性的影响。结果发现,虽然天然冰片和合成冰片均能够促进栀子提取物的渗透,但是天然冰片对其具有更好的保护效果,同时随着天然冰片比例的增加,栀子提取物的黏膜通透性增强,其对栀子苷稳定性的保护作用也增强,而合成冰片则无此功效。这些结果表明,合成冰片存在一定的不良反应,与之相比,天然冰片具有较高的安全系数。
天然左旋冰片与右旋冰片互为对映异构体,由于机体中的酶和蛋白等对药物分子的选择性不同,所以可能某些分子倾向于结合左旋冰片,另一些分子则与右旋冰片结合力更强。但目前针对天然左旋冰片与天然右旋冰片之间生物学活性比较的研究较少。受传统观念影响,人们一直认为木香来源的天然右旋冰片比草药香来源的天然左旋冰片更好,所以天然左旋冰片的使用并不像右旋冰片那样常见,因此关于左旋冰片的研究也相对较少。天然左旋冰片具有增加细胞膜流动性,提高Na+-K+-ATP酶活性,降低膜电位,调节细胞内钙离子浓度而跨越血脑脊液屏障(BBB)作用。Luo等对天然右旋冰片和天然左旋冰片对蛇床子素药代动力学的影响进行研究后发现,与单独蛇床子素组相比,当蛇床子素与冰片配伍后,其蛇床子素的药时曲线下面积(AUC0-t、AUC0-∞)和药峰浓度(Cmax)均显著提高;其中,当蛇床子素与天然右旋冰片合用时,蛇床子素的AUC0-t、AUC0-∞和Cmax分别增加61.561%、78.167%和51.769%;当蛇床子素与左旋冰片合用后,蛇床子素的AUC0-t、AUC0-∞和Cmax分别增加115.856%、167.786%和271.289%,药物的表观清除率(CL/F)降低60.686%。这些结果表明,天然左旋冰片对蛇床子素的药代动力学参数值增加的促进作用大于天然右旋冰片,但是对于天然右旋冰片和天然左旋冰片在联合用药中带来的不良反应差异文中并未阐述。另外也有研究表明,与天然右旋冰片相比,天然左旋冰片具有更强的黏膜刺激与肝毒性。因此,仍需要更多的研究阐明天然右旋冰片和天然左旋冰片之间的生物学活性以及毒理差异,以便更好地加以区分及应用。另外,由于不同研究所用冰片类型不一致,因此,对于以下关于冰片生物医学应用文献调研中未给出具体使用何种冰片种类时,一律标注为“冰片”。
2冰片在抗菌、抗炎、镇痛方面的应用
据记载,人们对冰片抗菌、抗炎、镇痛的功效研究历史长远。冰片对多种常见病菌(如大肠埃希菌、乙型溶血性链球菌、金黄色葡萄球菌、真菌等)具有高浓度可杀菌、低浓度可抑菌的功效。近年来,常颂平等研究发现,冰片作用后的黑曲霉菌结构遭到严重的破坏,导致该真菌溶解死亡,证明冰片对真菌也具有杀菌、抑菌的作用。吴硕文等在氟苯尼考联合天然冰片体外抗菌实验中发现,氟苯尼考联合天然冰片作用于大肠埃希菌、沙门氏菌和金黄色葡萄球菌的抑菌浓度(FIC)指数表明,冰片和氟苯尼考更多地呈现出加和作用,能明显降低氟苯尼考及天然冰片2种药物的使用浓度;虽然冰片具有抗菌作用的功能已被频繁证实,但是对于其抗菌机制并未有系统的解释。
冰片作为传统中药,在抗炎、抗卒中等方面被广泛应用。科学家们探究了冰片抗炎的机制。在脑缺血再灌注的大鼠模型中研究发现,冰片是通过降低包括细胞间黏附分子-1(ICAM-1)、肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、诱导型一氧化氮合酶(iNOS)、环氧化酶-2(COX-2)炎症相关细胞因子的表达而实现抗炎的过程。另一研究显示,冰片能降低细胞内活性氧(ROS)水平,并通过调控核因子κB(NF-κB)信号通路来抑制ICAM-1、TNF-α等炎症因子的产生,同时冰片能够阻断iNOS/一氧化氮(NO)信号的传导,从而达到抗炎、抗氧化和保护神经元的目的。此外,有研究通过脂多糖诱导小鼠单核巨噬细胞白血病细胞(RAW264.7)和大鼠发热模型评估了天然冰片和合成冰片的抗炎作用,结果表明天然冰片和合成冰片均能降低脂多糖诱导的RAW264.7细胞内的NO、TNF-α和IL-6炎症细胞因子的水平,且均能减缓内毒素引起的大鼠发热,从而实现抗炎;然而,天然冰片的抗内毒素热效应比合成冰片更明显,非靶向代谢组学研究结果说明这与天然冰片和合成冰片不同代谢组学特征有关。该研究应用了探究中医机制的代谢组学技术和现代研究技术相结合的方法,揭示了天然冰片和合成冰片治疗急性炎症存在的机制差异。因此,合成冰片能否完全代替天然冰片投入医药应用的问题仍有待进一步的探究。
冰片可消肿止痛,因而被广泛应用于治疗各种局部疼痛。如刘若金于《本草述》中叙述冰片能治疗喉痹肿塞、鼻瘜舌肿、下疳痔疮;而汪绂于《医林纂要·药性》中叙述冰片能治疗痰迷喉痹、舌胀牙痛、耳聋鼻瘜、痘毒疮痔,亦能生肌止痛。现代研究表明,冰片对多种创伤具有明显的抗炎镇痛功效。冰片是多靶点分子,目前关于其镇痛作用靶点已报道的有γ-氨基丁酸A型受体(GABAA)和瞬时受体电位通道蛋白1(TRPA1),但是有关冰片发挥镇痛功能时,GABAA和TRPA1是否有直接相互联系或信号传导间是否有相互串扰目前研究甚少。Wang等研究了冰片对122例术后疼痛患者的镇痛效果,结果显示,冰片单次治疗30~60min后有66%的患者疼痛强度降低50%以上,比安慰剂处理后表现出更明显的疼痛缓解作用;另外发现,瞬时受体电位M8(TRPM8)在冰片的镇痛中发挥重要作用,是冰片镇痛的关键靶点分子。该研究通过中医药研究与现代研究技术严谨结合的方法揭示了冰片镇痛作用的关键分子靶点,并通过临床试验验证了冰片的镇痛疗效,有利于推动天然产物冰片的现代化研究。
综上所述,冰片可以发挥良好的抗菌作用,但是抗菌机制尚不明确;天然冰片和合成冰片均能起到抗炎作用,但由于其代谢组学特征的差异性,抗炎效果差异较大。大多数研究表明,冰片可通过调节炎症因子的表达来实现抗炎作用;镇痛方面的研究显示,冰片可通过对多靶点分子如GABAA受体、TRPA1和TRPM8进行调控,从而实现镇痛作用。
3冰片在脑部保护作用中的应用
研究表明,冰片和脑部保护药物(如栀子苷和川芎嗪等)在全脑缺血再灌注损伤模型中对神经元的协同保护作用具有区域特异性,在海马、下丘脑和纹状体区域的协同作用尤其明显。研究人员进一步探索了磷酸川芎嗪(TMPP)联合冰片在保护大鼠下丘脑和纹状体的功能时是否存在协同作用,并检测了神经元中钙离子浓度变化及神经元自噬相关蛋白(比如丝氨酸/苏氨酸激酶、唯BH3域自噬蛋白、哺乳动物雷帕霉素靶蛋白和磷酸化腺苷酸活化蛋白激酶)与凋亡相关基因[如人体抑癌基因、B淋巴细胞瘤-2基因(Bcl-2)]的表达水平,结果表明,TMPP和冰片可通过降低神经元中钙离子的浓度,使神经元从有害性的细胞凋亡转变成保护性自噬,从而实现对下丘脑和纹状体的协同保护作用。另一项研究创新性地利用超声靶向爆破微泡技术(UTMD)证实,冰片减缓了缺血性脑卒中条件下经UTMD诱导的BBB损伤,即冰片对BBB具有保护作用,但保护机制尚不明确。
4冰片作为药物吸收促进剂的应用
药物吸收和生物利用度是评价药物治疗效果的重要参数。但是由于许多治疗性药物的细胞膜或肠道通透性低、转运蛋白的主动外排和(或)高代谢降低了药物的生物利用度,从而极大地限制了其治疗效果。在传统医学中,冰片常作为“佐使药”、“引经药”配伍应用。冰片具有促进药物透皮吸收和透过BBB的作用,从而可提高其他药物的血药浓度和生物利用度,因此冰片作为药物吸收促进剂方面的应用得到广泛研究。
4.1冰片促进药物的透皮吸收
透皮给药可避开肝脏代谢、胃肠道刺激,提高生物利用度,患者依从性好,副作用小。透皮给药面临的主要障碍是皮肤角质层。许多油类渗透促进剂能够促进疏水性和亲水性药物的透皮吸收。冰片作为芳香开窍中药代表,有脂溶性强、相对分子质量小、容易挥发、可改变脂质分子的排列和增加其流动性等特点,因而在药物的透皮吸收方面应用广泛。研究显示,冰片促进阿魏酸、盐酸川芎嗪、胰岛素和长春西汀的皮肤渗透吸收。Dai等通过采用神经酰胺-N-鞘氨醇、胆固醇和游离脂肪酸构建混合粗粒角质层脂质双层模型对冰片促进药物渗透机制进行研究,结果发现,低浓度的冰片能够使脂质双层疏松,促进药物的渗透,但是对强疏水性药物,其促透能力仍非常受限。冰片在高浓度下,导致水孔和长寿命反胶束的形成,从而改善了甲氧基欧芹酚和其他疏水性或亲水性药物通过角质层。另外,Yi等研究结果显示,冰片可以促进5-氟尿嘧啶、安替比林、阿司匹林、水杨酸和布洛芬等5种模型药物的体外经皮渗透吸收,其分子机制可能与冰片通过干扰角质层脂链的结构,引起皮肤渗透屏障的改变相关。
4.2冰片促进药物透过血脑屏障
BBB是中枢神经系统和血液的分界面,它是由脑毛细血管壁与神经胶质细胞形成的血浆与脑细胞之间的屏障和由脉络丛形成的血浆和脑脊液之间的屏障,这些屏障在阻止有害物质由血液进入脑组织的同时也阻止治疗性药物通过BBB,从而可削弱药物的治疗效果。冰片素有“开神通窍”,“芳香走窜,引经上行”之功效。不少研究证实冰片能够促进BBB的开放,增加BBB的通透性,从而增强药物的通透性。Zhang等研究显示,大鼠通过尾静脉注射25mg·kg-1的山奈酚(KA)与30mg·kg-1的合成冰片后,冰片显著提高了KA在大鼠脑中的生物利用度,冰片和KA联合组脑内KA的AUC0-inf比单独KA组的AUC0-inf提高了2.19倍,而冰片和KA联合组脑内的Cmax则比单独KA组增强了3.18倍。Fan等通过构建由大鼠脑微血管内皮细胞(BMECs)和星形胶质细胞组成的体外BBB模型研究冰片对BBB中的P-gp蛋白功能的影响,结果发现,冰片能够激活NF-κB信号通路,抑制P-gp的表达,从而增加罗丹明、异博定(戊脉安)和地高辛片跨BBB的累积。Wu等通过体外构建BBB模型研究冰片对葛根素(PUE)和川芎嗪(TMP)跨BBB的影响,结果显示,冰片能够通过抑制BBB连接蛋白ZO-1表达,增加腺苷受体A1AR和A2AR的表达,从而增加药物在大鼠脑中的累积渗透量。另外,汤丹丹等利用大鼠原代脑微血管内皮细胞与星形胶质细胞共培养建立BBB模型研究,25、50、100mg·kg-1的冰片对葛根素跨BBB作用的实验结果显示,100mg·kg-1的冰片能够增加BBB的通透性,促进葛根素和辛醇的跨膜累积。
4.3冰片促进其他黏膜系统对药物的吸收
Gao等对冰片提高姜黄素(Cur)口服利用度的可行性研究显示,通过灌胃给药,冰片可促进Cur在十二指肠、空肠和回肠的表观渗透系数(Papp),且PAPP随着冰片灌服浓度的增加而增大。大鼠体内动力学研究结果表明,Cur(40mg·kg-1)联合冰片(90mg·kg-1)组的AUC0-t是单独Cur(90mg·kg-1)组的2.53倍,是单独Cur(200mg·kg-1)组和单独冰片(90mg·kg-1)组的19.41倍;该研究结果表明,冰片联合Cur使用时能够增强Cur在十二指肠、空肠和回肠的吸收,提高其生物利用度,但该研究并未指出所用冰片种类。近年来,Huang等研究显示,当冰片与黄芩苷联合通过眼部给药时,冰片能够提高黄芩苷的体外通透性,同时将0.1%冰片与2%辛酸癸酸聚乙二醇甘油酯联合用药时,黄芩苷的吸收约为单独辛酸癸酸聚乙二醇甘油酯药物组的16.35倍,表明联合冰片的使用可以改善水和脂肪不溶性药物的角膜渗透性,提示冰片在眼科用药的潜在应用价值。
综上所述,冰片具有强大的黏膜促透作用,但针对冰片作为促透剂的作用机制尚不明确。目前,有研究认为冰片改变了脂质分子的排列和增加其流动性,从而有效改善了黏膜细胞的通透性。另有研究认为,冰片促进药物跨膜吸收的机制与其下调耐药蛋白的表达量、调控细胞间紧密连接的松散程度和黏弹性的损失量,破坏紧密连接、降低黏液黏度和弹性、抑制外排转运蛋白等有关。
5冰片作为化疗增敏剂的应用
化学治疗(化疗)指应用化学药物(包括内分泌药物)治疗恶性肿瘤。抗癌药物进入体内后很快分布至全身,既可杀灭局部的肿瘤细胞,也可杀灭远处转移的肿瘤细胞,因此化疗是一种全身治疗。在肿瘤的综合治疗中,药物治疗占据举足轻重的地位。阿霉素(DOX)、顺铂、5-氟尿嘧啶、金诺芬等作为抗肿瘤一线治疗药物已被广泛应用。因此,化学治疗是大部分实体肿瘤和血液系统肿瘤的首选治疗方案。但是,原发性及获得性耐药极大地影响了化疗的效果,高剂量化疗药物的不良反应也使得患者难以耐受或无法继续完成治疗。冰片作为一种吸收促进剂,可通过抑制多药耐药蛋白的过度表达,单独或与其他佐剂合用,增强肿瘤细胞对化疗药物的敏感性。因此,其在化疗增敏剂方面有巨大的潜在应用价值。目前,国内外针对冰片作为化疗增敏剂的研究比较少。P-gp是一种典型的药物外排泵,在多种肿瘤细胞中均有过表达,它能将细胞毒性药物从胞浆中泵出,从而降低细胞内药物浓度。因此,抑制P-gp可抑制P-gp介导的多药耐药表型,提高化疗疗效。陈艳明等研究显示,冰片联合长春新碱能够显著提高长春新碱的抗肿瘤活性,冰片在增敏过程中的作用机制可能与其显著抑制P-gp活性有关。杜杭根等研究发现,冰片联合顺铂能够显著增加顺铂抑制大鼠C6脑胶质瘤生长能力,其作用机制可能与冰片通过促进顺铂透过BBB后累积,从而在胶质瘤部位发挥作用有关。硒代胱氨酸(selenocystine,SeC)是一种具有广谱抗肿瘤活性的化合物。然而,SeC稳定性差、溶解性差,阻碍了其渗透细胞膜,阻碍了其作为抗肿瘤药物的进一步发展。笔者所在课题组前期研究结果发现,天然右旋冰片可提高HepG2细胞对SeC的摄取,从而导致SeC在细胞内产生更多的ROS,进一步地增强SeC诱导DNA损伤,由此产生更为显著的抗肿瘤效果。同样的,Cur尽管具有较强的生物活性,但由于其不溶于水,吸收能力差,新陈代谢快,其生物利用度极低。笔者所在课题组研究发现,天然右旋冰片与Cur通过诱导凋亡来增强其对A375人黑色素瘤细胞的抗增殖活性:天然右旋冰片和Cur作用后,磷酸化c-Jun氨基末端激酶(JNK)表达上调,磷酸化细胞外调节蛋白激酶(ERK)和细胞外调节蛋白激酶(AKT)表达下调是导致A375细胞凋亡的原因之一;冰片还通过上调磷酸化共济失调毛细血管扩张突变基因(ATM)、磷酸化乳腺癌1号基因(BRCA1)和磷酸化p53的表达水平,增强Cur在细胞内诱导ROS的过量产生,进一步诱导更为显著的DNA损伤效应。此外,天然右旋冰片能增强去甲氧基姜黄素(DCur)或二去甲氧基姜黄素对HepG2细胞的抗肿瘤作用,表现为天然右旋冰片联合DCur可通过触发ROS介导的MAPK和AKT信号通路的激活以及诱导DNA损伤而实现。此外,天然右旋冰片能够通过抑制PI3K/AKT通路而增强紫杉醇(PTX)诱导的人食管鳞状细胞癌(ESCC)细胞凋亡,该结果提示冰片和PTX联合治疗在食管癌治疗中的可行性。
6冰片促进纳米药物吸收与递送
纳米技术融合医学、生物学、药理学、药学、化学、材料学、工程学等,在多学科领域展现出了广阔的应用前景。纳米载药系统易于表面靶向修饰、循环,且滞留时间长、易渗透进入细胞、可实现缓释和控释等优势,可以克服现有小分子药物制剂所存在的生物选择性差、利用率低、稳定性差、药物作用时间短、不良反应严重等缺陷。通过纳米材料运载化疗药物特异性地进入肿瘤组织深处,并通过高通透高滞留效应(EPR)优先高浓度地聚集在肿瘤部位,而在正常组织中聚集浓度较低,从而提高药物的治疗效率,降低药物对正常组织的不良反应。然而,由于细胞间与细胞间转运、增强的渗透性和保留效应等影响,纳米粒在肿瘤基质的运输也会受到影响,也可能存在竞争器官,因此,真正被递送至实体瘤的纳米粒仅占给药剂量的0.7%,这极大地阻碍了纳米医学的临床转化。因此,对于如何解决纳米粒的递送及其在肿瘤部位的吸收与累积问题显得极其重要。冰片具有促进不溶性药物透皮吸收以及可提高其他药物的血药浓度和生物利用度等作用。因此,基于冰片强大的促透能力,在纳米药物中引入冰片,这将有望提高纳米药物的跨膜吸收及向肿瘤组织的递送量。
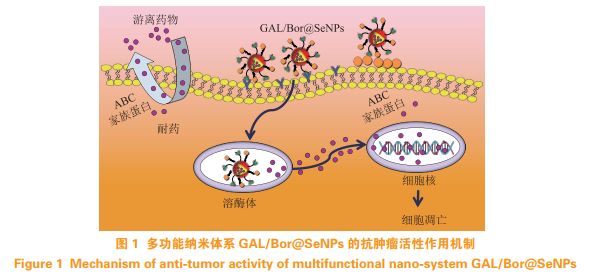
目前,在冰片修饰的纳米载药体系中,研究人员较倾向于运用物理方法(如超声乳化法、双乳液法和溶剂蒸发法等)和化学方法。为了实现药物在脑部的靶向治疗,有研究在神经毒素纳米体系中通过物理方法混合了冰片-薄荷脑共熔物,证实了此吸收促进剂能明显地促进药物跨过BBB,提高药物在脑部的积累含量。Ren等通过对比冰片修饰和非冰片修饰的昔洛韦固体脂质纳米粒在小鼠脑部的分布情况发现,冰片通过微乳液法混合修饰的纳米系统更能增加更昔洛韦向脑部递送,因此,用冰片修饰的固体脂质纳米粒有望成为提高药物运输到中枢神经系统的递送系统。另一研究利用冰片的双环单萜结构和二烯酰基磷酸乙醇胺(DOPE)发生酰胺反应,制备了脂质纳米粒(BO-SLN/CM),并对比了通过乳液和溶剂蒸发法合成的脂质纳米粒(BO-SLN/PM)和固体脂质纳米粒(SLN)的粒径和形态特征,发现BO-SLN/CM、BOSLN/PM与SLN具有相似粒径(约87nm)和相同形态特征;与BO-SLN/PM和SLN相比,BO-SLN/CM具有更低的细胞毒性,更高的细胞吸收性和更好的BBB渗透性,BO-SLN/CM对大脑具有显著的靶向功能;因此,经过化学修饰的冰片固体脂质纳米粒更具有靶向大脑并透过BBB的应用潜力。笔者所在课题组前期通过设计合成多功能的纳米体系GAL/Bor@SeNPs,并对其进行肝癌细胞的P-gp活性抑制、体外抗肿瘤活性研究结果表明,多功能的纳米体系能够通过靶向肝癌细胞的去唾液蛋白酶受体,抑制耐药细胞表面的P-gp,并且能够诱导ROS依赖的细胞凋亡,同时,激活MAPK、AKT、p53等信号(见图1)。为了克服神经胶质瘤治疗中遇到的BBB和抗肿瘤药物在颅内扩散的问题,Xu等利用冰片和叶酸通过化学方法双重修饰聚酰胺-胺型树枝状高分子(PAMAM)并递送DOX,结果显示,冰片的修饰提高了递送系统的BBB渗透性,叶酸的修饰提高了递送系统的胶质瘤靶向性。Yang等以多西紫杉醇(DTX)为载体,以聚亚胺基叶酸和聚乙烯亚胺-冰片(PEI-BO)为包膜,制备了聚乳酸-羟基乙酸(PLGA)纳米粒(FA/BO-PLGA-NPs),结果显示,FA/BO-PLGA-NPs在肠道的吸收量约为单独DTX吸收量的6.0倍,其生物利用度比DTX悬液提高了约6.8倍,且对肠道无明显刺激作用,因此,FA/BO-PLGA-NPs制剂显著提高了DTX的口服生物利用度,在口服给药方面显示出良好的应用前景。
综上所述,冰片在纳米生物医药领域的应用取得一定进展,经过冰片修饰或将冰片做成复合纳米体系后,纳米药物的细胞和组织穿透能力得到增强,药效学活性也有所提高。因此,开发新型的冰片修饰纳米制剂,将为解决目前纳米药物在实体瘤递送差的难题和促进纳米医学的临床转化提供新策略。
7冰片的纳米化制备及其生物医药应用
虽然冰片具有良好的生物活性,然而,由于冰片的水溶性差,易于升华的特性限制了其在生物医药方面的进一步应用。因此,为了阻止冰片升华,需提高冰片的水溶性和稳定性。通过纳米技术对冰片进行纳米化改造具有重要意义,目前针对这一方面的研究还相对较少。杨黎等将冰片粉碎后过筛,将其与油相进行研磨混匀后加入双蒸水,选择十二烷基磺酸钠作为表面活性剂进行水包油乳化,从而得到了水包油的微乳液;该方法解决了冰片易挥发和含冰片药物冰片含量极易下降的难题,提高了冰片在其他药物中的稳定性,进而增强其他药物的治疗效果。吕长江等利用转相法制备了冰片鸦胆子油纳米乳(BBNE),相比于鸦胆子油注射剂组、鸦胆子油纳米乳组,BBNE的抑瘤率显著提高,高达56.94%,因此,BBNE中的冰片能够提高鸦胆子油通过BBB的能力,增加鸦胆子油在脑部的含量,从而增强鸦胆子油的抗肿瘤活性。
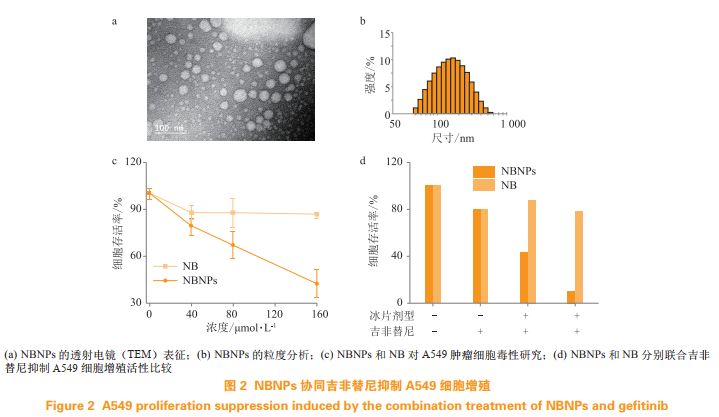
笔者所在课题组最近对天然右旋冰片进行了纳米化剂型的改造,利用高压均质法优化设计了右旋冰片纳米粒(NBNPs):一方面,通过油相包裹了天然右旋冰片,防止其升华,解决了其在机体内不稳定的弊端;另一方面,外层水相赋予了NBNPs优良的水溶性和生物相容性。体内外抗肿瘤活性的研究表明,相比于单独天然右旋冰片,NBNPs能高效、选择性地抑制A549肺癌细胞的增殖;同时,NBNPs联合抗肺癌药物吉非替尼(geftinib)能显著增强A549肺癌细胞对抗癌药物的敏感性,从而提高吉非替尼的杀伤作用(见图2)。笔者所在课题组的另一研究中,利用丙酮溶解PLGA和天然右旋冰片作为油相,选择Tween80作为表面活性剂,制备了水包油的聚合物天然右旋冰片纳米粒子(PLGA@NB);体外抗肿瘤实验显示,相比于单独天然右旋冰片,PLGA@NB抑制A549肺癌细胞增殖的能力显著提高,在A549细胞中,单独DOX组IC50大于0.8μmol·L-1,天然右旋冰片联合DOX组中DOX的IC50稍有下降,而PLGA@NB联合DOX组中DOX的IC50却降至0.08μmol·L-1,表明PLGA@NB高效显著地提高了DOX的抗肿瘤活性。
综上所述,通过纳米技术将冰片进行纳米化后,增强了冰片的水溶性和稳定性,同时也显著提高了其生物活性。这为纳米化冰片作为化疗增敏剂的开发及其他药物领域应用方面提供了参考。
8结语与展望
冰片作为传统中药,在临床上已有两千多年的应用历史,基于其促透作用,冰片在各种黏膜吸收促进方面研究较为广泛,尤其针对透皮吸收以及BBB影响方面的研究更是重点之一。但是目前其促透作用机制尚未得到阐述。因此,如何解决这一问题,使冰片更好地扬长避短,是今后人们研究的重点方向之一。冰片能够在减少化疗药物剂量,降低不良反应的同时提高药物的跨膜吸收能力,增强药物活性,因此在癌症化疗增敏剂方面具有巨大的潜在应用价值。如何合理利用和开发冰片作为化疗增敏剂,从而推动冰片生物医学应用具有重要意义。同时,根据人体正常组织的微血管,肿瘤组织中血管结构差异以及纳米载体类药物的“增强渗透与滞留效应”,通过纳米生物技术对冰片进行纳米化剂型改造,从而增强冰片稳定性、肿瘤细胞选择性和靶向药物对肿瘤生长的抑制作用,或用冰片修饰纳米转运系统增强药物作用效果,以及明确冰片作为增敏剂的作用机制也是未来冰片在生物医药应用方面的重点发展方向之一。
来源:ppsyxjz 药学进展
原文链接:http://mp.weixin.qq.com/s?__biz=MzA5MDY3ODExNQ==&mid=2651306393&idx=1&sn=8e858090fd91ff1a918db7a2df95318c&chksm=8bf4ef95bc8366837620498a2396d0d806bcdde482eef4689138191b321d85aa09a8aa0de660&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
新法使用磁性纳米粒子治疗癌症
【新科技知识干部读本】海洋药物研究有利于新药研发
2015年(第五届)药物毒理学年会在海口市顺利召开




硅纳米粒子有助“曝光”肿瘤集聚区

医用纳米粒子可为农作物输送营养
第六届全国药物毒理学年会在重庆成功举办



基于深度学习的单纳米粒子定向感知
纳米粒子自组装制备2D准纳米片
抗癌抗菌的混合纳米粒子问世

“悬浮”纳米粒子助力量子计算