科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-21
来源:BioArt
原标题:Mol Cell:治疗肥胖新曙光:阮丽蓉团队发现促进米色脂肪细胞的产热效应并抑制肥胖的新机制
N-端乙酰化是真核细胞最常见的蛋白修饰之一,常见于可溶性细胞质蛋白以及跨膜蛋白。不同于被广泛研究的翻译后赖氨酸乙酰化,“N-端乙酰化”通常发生在蛋白质翻译时期,是指在蛋白质N端氨基(即蛋白质的第一个氨基酸的第一个碳上的氨基)添加乙酰基。事实上,人类细胞中超过80%的蛋白质具有N端乙酰化修饰,其中一半的蛋白质(约38%总蛋白质)的N端乙酰化是由N-α-乙酰基转移酶10(Naa10p)所修饰。已知,此类高丰度的蛋白质N端乙酰化修饰与癌症,例如肺癌、前列腺癌等,以及发育相关疾病,例如奥格登综合征、智力发育缺陷等息息相关【1】。但是,对于蛋白质N端乙酰化修饰到底在生理与疾病方面扮演何等角色,是一个基础且重要的问题。
近年来,来自台湾“中央研究院”基因体研究中心的阮丽蓉教授与其研究团队聚焦于上述科学难题,构建小鼠动物模型,深入探究了Naa10p在早期胚胎发育时期所扮演的功能。2010年,研究团队于J Clin Invest 阐明了人类Naa10p过量表达,可通过与 DNA 甲基化转化酶 DNMT1作用,造成抑癌基因启动子甲基化,进而抑制抑癌基因表现,导致肺癌病变【2】。2017年,阮丽蓉教授研究团队和哈佛医学院张毅教授合作,于Molecular Cell阐明了Naa10p具有乙酰基转移酶非典型功能—“能与基因组印记DNA结合、吸引DNMT1至基因组印记区(Imprinted Allele)、维持DNMT1酶活性,借此维持着床前胚胎基因组印记甲基化”,为人罕见疾病性联遗传奥格登综合征(X-linked Ogden Syndrome)提供了致病的分子机制以及治疗(药物)开发的新方向【3】。携带有Naa10p突变的奥格登综合征病人,均于一岁半前死亡,且此类病人缺乏皮下脂肪,出现早老症状。
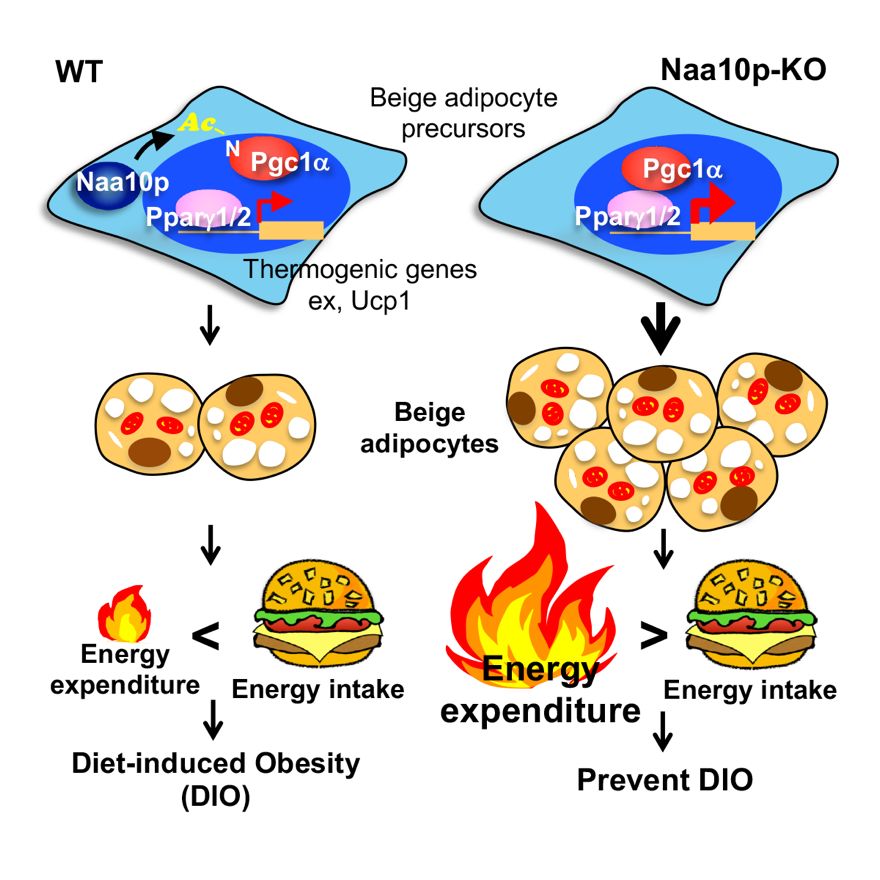
2019年8月15日,阮丽蓉教授与其研究团队于Molecular Cell 在线发表了题为Naa10p Inhibits Beige Adipocyte-Mediated Thermogenesis through N-a-acetylation of Pgc1α的新一项研究成果。研究团队利用全身性和脂肪特异性Naa10p敲除小鼠动物模型,证明了Naa10p能抑制米色脂肪细胞分化、能量消耗和产热。结合生化方法,该研究揭露了Naa10p乙酰化转录辅助激活因子Pgc1α的N端。此一修饰阻止Pgc1α与转录因子Pparγ相互作用,借此抑制米色脂肪细胞分化增生与产热功能的关键基因激活。最重要的是,研究人员利用人类脂肪组织库发现Naa10p基因表达与人类肥胖(身体质量指数Body Mass Index, BMI)呈正相关,近一步阐述了Naa10p基因高量表达于饮食诱导的肥胖的生理意义。

热量/食物摄取过量且高于人体消耗效即造成肥胖,进而造成罹患心血管疾病、糖尿病及脑梗的风险增加。因此,饮食诱导的肥胖严然成为重大的健康、医疗与经济问题。哺乳动物的脂肪组织在生理代谢、能量平衡及体温调控中扮演着关键性的角色,其可粗略区分为:储存脂肪的白色脂肪组织与消耗脂肪的棕色/米色脂肪组织。饮食诱导的肥胖,可以因白色脂肪组织中的米色脂肪细胞产热效应缺失而引起。有鉴于此,如何在白色脂肪组织中促进米色脂肪细胞增生、分化及活化(消耗脂肪产热),已成为治疗肥胖最有吸引力的疗法之一【4】。
研究人员首先通过全身性和脂肪特异性Naa10p敲除小鼠动物模型,发现了Naa10p敲除小鼠对高脂肪饮食诱导的肥胖及糖代谢紊乱有极高的耐受性。在高脂肪饮食的条件之下,Naa10p敲除小鼠体内白脂肪组织含量减少、相反地米色脂肪细胞却大量增加、呈现较高的能量消耗率,并且面临寒冷环境具备更佳的产热效率。研究团队利用体外诱导米色脂肪细胞分化模型,探究Naa10p于米色脂肪细胞分化与活化(产热)所扮演的功能。在此基础上,研究人员发现缺乏Naa10p的米色脂肪细胞持续高量表达产热相关基因,此一现象并非3-肾上腺素受体异常活化造成。进一步利用Naa10p补偿模型,发现Naa10p的乙酰转移酶活性(乙酰基转移酶典型功能)能够抑制米色脂肪细胞内产热相关基因转录表达,以及抑制线粒体介导的氧化电子传递链(产热)—米色脂肪细胞主要的生理功能之一。
结合生物信息、分子生物学及生物化学方法,研究人员揭露Naa10p众多底物中的其中一个—转录辅助激活因子Pgc1α,在Naa10p剔除介导之米色脂肪细胞活化(产热)所扮演的关键角色。Naa10p乙酰化修饰转录辅助激活因子Pgc1α的N端,此修饰阻止Pgc1α与转录因子Pparγ结合,借此抑制米色脂肪细胞分化、增生与产热功能的关键基因激活。
该研究成果首次从分子、细胞、动物及人体四个层次阐明了Naa10p介导之蛋白质N端乙酰化的重大生理功能;并且提出了“抑制脂肪组织中Naa10p的酶活性可能增生米色脂肪细胞且活化其产热效应”的新观点。因此,开发Naa10p酶活性抑制剂将有利于对抗饮食诱导的肥胖同时改善肥胖诱导的糖尿病。结合先前研究,可知Naa10p基因为发育所需,但一旦发育完全,过量表达Naa10p将导致肥胖及癌变。此项研究不仅揭示了Naa10p导致肥胖的机制,提出肥胖与癌变的关联,更为治疗肥胖提出新策略。我们预期,抑制成人脂肪组织中Naa10p的酶活性可抑制饮食诱导的肥胖。本研究成果为开发治疗肥胖药物(减肥药)与糖尿病药物提供了新的靶点与方向;为生物制药与促进人类健康提供了科研基础。
原文链接:
https://doi.org/10.1016/j.molcel.2019.07.026
参考文献
1. Aksnes, H., R. Ree, and T. Arnesen, Co-translational, Post-translational, andNon-catalytic Roles of N-Terminal Acetyltransferases. Mol Cell, 2019. 73(6): p. 1097-1114.
2. Lee, C.F., et al., hNaa10p contributes to tumorigenesis byfacilitating DNMT1-mediated tumor suppressor gene silencing. J Clin Invest,2010. 120(8): p. 2920-30.
3. Lee, C.C., et al., The Role of N-alpha-acetyltransferase 10Protein in DNA Methylation and Genomic Imprinting. Mol Cell, 2017. 68(1): p. 89-103.
4. Wang, W. and P. Seale, Control of brown and beige fat development.Nat Rev Mol Cell Biol, 2016. 17(11):p. 691-702.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474161&idx=2&sn=679601cf84e8b3fb718b321fa80228f0&chksm=84e21885b3959193641bcbf5663a1173b858f6bbef03584a0afa6cc78a19fad05e7bbf383087&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn