科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-23
来源:BioArt
编者按:曹雪涛院士长期从事天然免疫反应,自身免疫及肿瘤免疫的机制研究。近年来,曹雪涛院士以表观遗传为切入点,研究DNA修饰,RNA修饰,蛋白修饰和非编码RNA在免疫调控中的功能,取得了多项重要研究成果:2017年发表在Cell上的论文揭示甲基转移酶SEDT2介导的STAT1甲基化在抗病毒免疫中的重要作用;同年在Science上报道病毒通过激活宿主LncRNA-ACOD1,调控代谢酶GOT2活性,促进病毒感染的机制;2018年在Cell报道长非编码RNA lnc-Lsm3b改变RIG-I蛋白构象,抑制免疫反应过激的机制;2019年在Science报道鉴定了一种新型细胞核内病毒DNA感受器蛋白hnRNPA2B1。曹雪涛院士的研究关注免疫调控中的重要科学问题,推动了表观遗传在免疫调控中的研究,具有重要理论和临床意义。今天,曹雪涛院士在Science发表研究,将RNA m6A修饰、细胞代谢和病毒感染三者联系在一起,揭示了宿主细胞通过非天然免疫依赖途径抵御病毒感染的新机制!
细胞代谢是所有生物过程的能量和材料来源。在病毒感染过程中,病毒会改变宿主细胞的代谢网络,以适应自身复制存活的需要;同时,宿主细胞检测到病毒感染后,也会积极地改变细胞代谢以抵御病毒感染。可见,代谢在宿主与病毒的博弈中起到了重要作用【1-3】。但参与调控病毒感染的代谢酶和代谢物还需进一步研究。
m6A修饰是mRNA上丰度最高的化学修饰,也是近年来研究的热门,甚至带动了RNA表观遗传领域的发展。m6A修饰广泛的参与到各种生理过程中,包括调节干细胞分化,DNA损伤修复,学习记忆,癌症进程和生长发育等。在免疫反应中,m6A也被证明参与了宿主和病毒间的交流。METTL3/14介导的寨卡病毒RNA m6A修饰导致病毒RNA的降解【4】。然而,目前关于宿主细胞自身m6A变化如何影响病毒感染进程,尚不清楚。
2019年8月23日,曹雪涛院士团队(第一作者为刘洋博士)在Science杂志发表文章N6-methyladenosine RNA modification-mediated cellular metabolism rewiring inhibits viral replication,揭示了宿主细胞通过抑制m6A去甲基化酶ALKBH5的活性,降低OGDH基因表达和衣康酸的产生,从而抑制病毒复制的机制。该研究提出了宿主可不依赖天然免疫方式而抵御病毒感染的新机制,证明RNA表观遗传与细胞代谢协同抵御病毒感染,为病毒感染性疾病的干预与治疗提供潜在药物靶点。

为研究m6A修饰在宿主细胞抗病毒反应中的功能,研究者在VSV病毒(vesicular stomatitis virus,水泡性口炎病毒,一种RNA病毒)感染小鼠腹腔巨噬细胞后,检测了巨噬细胞m6A水平的变化,发现m6A的变化趋势与VSV病毒含量正相关,即呈现先上升后下降的趋势,说明m6A参与宿主细胞与病毒间的交流。进一步,敲低m6A去甲基化酶ALKBH5能显著降低VSV病毒的RNA水平,提示敲低ALKBH5抑制病毒感染。
天然免疫反应(innate immune response)是宿主细胞抵抗病毒感染的经典途径,然而研究者发现敲低ALKBH5并不影响I型干扰素(IFN-β and IFN-α),TNF-α和IL6的表达,说明ALKBH5不通过天然免疫信号通路影响抗病毒反应。
那么,ALKBH5在宿主细胞与病毒互作中的生理意义是什么?ALKBH5如何参与宿主的抗病毒反应?为什么敲低ALKBH5能抑制病毒的复制?
为了回答以上问题,研究者首先检测病毒感染后ALKBH5的变化。有趣的是,在病毒感染后,ALKBH5的蛋白表达量和定位均未发生变化,而其去甲基化酶的活性却明显降低。转录后修饰是调控蛋白活性的重要方式,并参与免疫反应的调控。例如,宿主细胞可通过诱导STAT1和IRF3的甲基化促进病毒的清除【5,6】。蛋白质谱的分析显示在病毒感染后,ALKBH5蛋白的R107和D109发生去甲基化,而K345和R349则被甲基化修饰。这四个位点的修饰是否影响了ALKBH5的活性?通过基因突变载体的构建,研究者发现过表达将R107突变为R107Q的ALKBH5,不能提高m6A水平和VSV病毒的含量,提示R107对ALKBH5的去甲基化酶活性和抗病毒反应非常重要。(H205为已报道ALKBH5酶活性位点)
以上结果说明在病毒感染后,宿主细胞通过去除ALKBH5蛋白R107位的甲基化,抑制ALKBH5的活性,从而抑制病毒的复制。那么,ALKBH5影响病毒感染的具体机制是什么?为确定ALKBH5的下游靶基因,研究者做了RNA-seq和m6A-seq。KEGG分析显示代谢通路对ALKBH5的变化响应最明显。其中,OGDH(酮戊二酸脱氢酶)基因的m6A水平在敲低ALKBH5后上升,而其表达量明显下调,并发现OGDH的下降由m6A阅读蛋白YTHDF2介导。提示OGDH可能参与ALKBH5的抗病毒免疫反应。
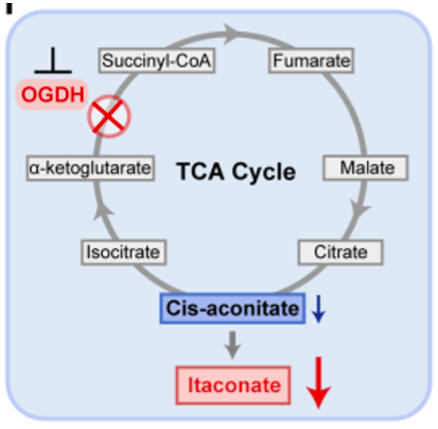
OGDH是三羧酸循环的第一个限速酶(上图),但是目前并没有报道发现OGDH参与抗病毒免疫反应。那么,OGDH是否于病毒感染相关,又是如何参与其中的呢?研究者发现敲低OGDH可以模拟ALKBH5缺失的表型,这提示OGDH是ALKBH5调控抗病毒反应中重要的下游基因。进一步,代谢物成分分析显示,衣康酸是敲低ALKBH5和OGDH后含量变化最明显的代谢产物。已有研究发现衣康酸在巨噬细胞中具有明显的抗炎活性【7,8】,但是它在抗病毒免疫中的功能还未见报道。研究者用衣康酸处理感染病毒的小鼠,发现肝脏、脾脏和肺中的病毒含量明显上升,提示衣康酸促进病毒的复制,抑制宿主细胞的抗病毒反应。
以上结果说明RNA m6A去甲基化酶ALKBH5具有广泛地促进不同类型病毒复制的作用。在病毒感染情况下,宿主细胞通过抑制ALKBH5酶活性来提高OGDH基因的m6A修饰,促进OGDH mRNA的降解,从而降低代谢物衣康酸产生,最终抑制了病毒复制。
同时,我们也注意到,该研究首次报道了ALKBH5 R107位甲基化修饰对其本身去甲基化酶活性至关重要,而宿主如何调控ALKBH5 R107的甲基化和去甲基化?行使相关功能的酶又是什么?尚不清楚。另外,衣康酸是巨噬细胞抗炎反应中的重要代谢分子,也是近年来的研究热点(详见BioArt报道:Nat Chem Biol | 北大王初/陈兴合作利用半胱氨酸糖基化揭示衣康酸对糖酵解的调控作用)。衣康酸通过负反馈调控糖酵解通路到达抗炎活性分子的作用。而在抗病毒反应中,衣康酸却从抗炎反应中宿主细胞的“帮手”变成了促进病毒复制的“帮凶”,这其中的机制是什么,有待进一步研究。
总的来说,宿主细胞可以通过多种方式方法抵御病毒感染,例如通过干扰素产生等天然免疫功能能够有效抵御病毒感染。但目前对于宿主细胞能否通过非天然免疫依赖途径抵御病毒感染以及相关作用机制尚不十分清楚。该研究为了解非天然免疫依赖方式的细胞防御和清除入侵病毒机制提供了新的视角,提出了宿主细胞如何主动应对病毒感染、通过表观修饰与代谢重塑交叉调控机制抑制病毒复制的新观点,为病毒-宿主相互作用以及抗病毒途径的未来研究提供了新思路。
原文链接:
https://science.sciencemag.org/content/early/2019/08/21/science.aax4468
参考文献
1. A. J. Olive, C. M. Sassetti, Metabolic crosstalk between host and pathogen: sensing,
adapting and competing. Nat Rev Microbiol 14, 221-234 (2016)
2. A. Wang, H. H. Luan, R. Medzhitov, An evolutionary perspective on immune metabolism. Science 363, (2019).
3. P. Wang, J. Xu, Y. Wang, X. Cao, An interferon-independent lncRNA promotes viral replication by modulating cellular metabolism. Science 358, 1051-1055 (2017).
4. G. Lichinchi et al., Dynamics of Human and Viral RNA Methylation during Zika Virus Infection. Cell Host Microbe 20, 666-673 (2016)
5. K. Chen et al., Methyltransferase SETD2-mediated methylation of STAT1 is critical for interferon antiviral activity. Cell 170, 492-506 e14 (2017).
6. C. Wang et al., The methyltransferase NSD3 promotes antiviral innate immunity via
direct lysine methylation of IRF3. J Exp Med 214, 3597-3610 (2017).
7. V. Lampropoulou et al., Itaconate links inhibition of succinate dehydrogenase with macrophage metabolic remodeling and regulation of inflammation. Cell Metab 24, 158-166 (2016).
8. E. L. Mills et al., Itaconate is an anti-inflammatory metabolite that activates Nrf2 via alkylation of KEAP1. Nature 556, 113-117 (2018).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474300&idx=1&sn=9bc9c616f9883fd359935a780110fa65&chksm=84e21808b395911e9a9ec6bf3d5d982eef90b5db6f0275e69f38e78ac3ad2fa76a03065ee76a&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

当DNA甲基化遇上RNA甲基化:果实成熟的表观遗传调控
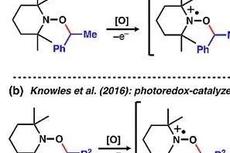
JACS:新型甲基化试剂—TEMPO-Me
氯甲基化反应
m6A(RNA甲基化修饰)热点分析

生物钟调控代谢新方式揭示

是什么让脊椎动物如此特别
Nat Plants:植物如何防晒?抑制DNA甲基化
甲基化过程

抽管血,揪出癌症“指纹”

儿童营养不良,甲基化随之改变