科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-03
来源:BioArt
原标题:Nat Micro:王红艳/魏滨/胡荣贵合作揭示内质网定位的Hrd1协同细胞膜TLR4受体促进炎症反应的新功能和机制
位于细胞表面的Toll样受体4(TLR4)对于细菌引起的NF-κB活化和炎症因子分泌非常关键,中科院生化与细胞所王红艳课题组前期鉴定一系列位于细胞膜的受体VEGFR-3,位于细胞浆的激酶STK4(又称MST1)和下游YAP,位于细胞核的TET3及RUNX1在抗细菌或病毒感染中的关键功能。但是至今很少有报道提出特定细胞器定位的关键分子能参与TLR4通路和巨噬细胞的抗细菌感染功能。
2019年9月2日,中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)王红艳研究组、胡荣贵研究组联合武汉病毒所魏滨教授合作(博士生路瑶和邱颖为共同一作)在Nature Microbiology杂志上发表了的最新工作ER-localized Hrd1 ubiquitinates and inactivates Usp15 to promote TLR4-induced inflammation during bacterial infection,揭示了内质网定位的E3泛素连接酶Hrd1通过招募去泛素化酶Usp15,特异性促进细菌感染中TLR4诱导的炎症反应,成为LPS或者盲肠穿刺诱导败血症休克的重要新靶点。

研究人员通过对280多个E3泛素连接酶的筛选,鉴定出内质网定位的E3连接酶Hrd1能协同细胞膜TLR4受体,促进细菌感染导致的炎症反应。内质网(ER)是分布最广的细胞器,可以和细胞内多种细胞器接触传递信号等功能。研究人员证实内质网定位的Hrd1对TNF-α、TLR3、TLR9通路中IL-6的产生影响不显著,主要调控了TLR4诱导的炎症反应。作为E3泛素连接酶,Hrd1直接招募去泛素化酶Usp15,并对Usp15上第21位的赖氨酸残基进行K27型的泛素化修饰。与经典的Hrd1参与内质网应激降解错误折叠蛋白的功能(即ERAD)不同,被泛素化的Usp15不被降解,而是失去Usp15去泛素化酶活性,不能对IκBα去泛素化,最后导致NF-κB的过度活化(下图)。在巨噬细胞中特异性的敲除Hrd1可以保护小鼠免于LPS或者盲肠穿刺诱导的败血症休克。
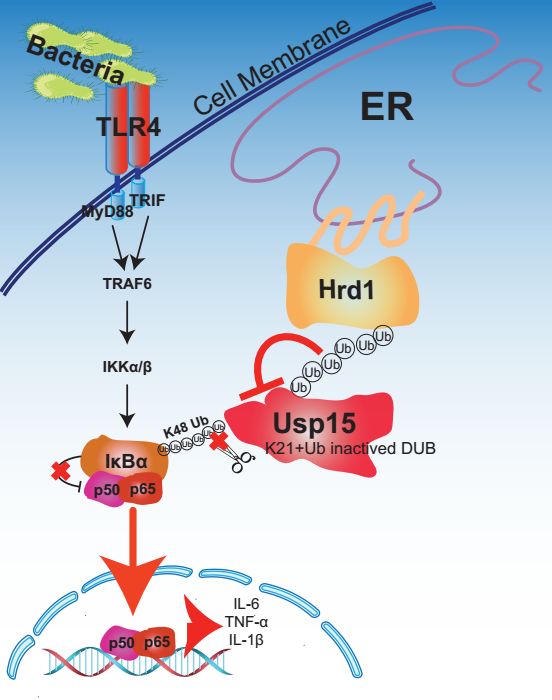
内质网定位的Hrd1协同细胞膜TLR4受体促进炎症反应的模式图
总的来说,这项工作不仅揭示Hrd1的新功能和Usp15翻译后修饰的新机制,而且有希望为Hrd1及Usp15相关疾病的治疗提供新的靶点。
据悉,王红艳研究员、武汉病毒所和上海大学的魏滨教授、胡荣贵研究员作为本文的共同通讯作者。王红艳课题组的博士生路瑶和邱颖为本文共同第一作者。
附王红艳课题组招聘信息:
数名博士后、研究助理(生命科学领域获得硕士或博士学位)。在领域内有影响力期刊上发表过科研论文的应聘者,欢迎随时联系。王红艳研究员获国家自然基金委“杰出青年”、“优秀青年”、中科院优秀指导老师称号、中科院“百人计划”和上海市“浦江人才”计划的支持。长期从事巨噬细胞和T细胞调控炎症相关疾病的研究,近5年作为通讯作者,在Immunity、Nature Microbiology、J Clin Invest、J Exp Med、 EMBO Mol Med等发表14篇论文。王红艳课题组的简介见链接:http://www.sibcb.ac.cn/PI.asp?id=132
原文链接:
https://www.nature.com/articles/s41564-019-0542-2
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652474776&idx=2&sn=7e58ab40e87794fa27bf44aec55ba7d5&chksm=84e21e2cb395973afdf6f8151bb39487ef0ed446045474c4d865f165735f191793393709355c&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn