科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-15
来源:小张聊科研
医学界素有盛名的顶级医学杂志《The New England Journal of Medicine》(《新英格兰医学杂志》,IF:70.670)是美国的老牌SCI期刊。从9月11日至今,该杂志已经连续3天在官网首页展示来自一项来自中国的研究——基因编辑干细胞治疗艾滋病和白血病患者。原文标题为:CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia(利用CRISPR基因编辑的成体造血干细胞在患有艾滋病合并急性淋巴细胞白血病患者中的长期重建)[1]。
这是一项由北京大学-清华大学生命科学联合中心邓宏魁研究组领衔,解放军总医院第五医学中心及首都医科大学一起协作的项目,是世界首例利用基因编辑技术治疗患有白血病的艾滋病病人。该实验主要有3处亮点引人瞩目。
首先,该文章的研究对象的选择是患有急性淋巴细胞白血病的艾滋病患者,这是经过一番思考的。是读者容易困惑的地方,也是文章精彩之处,不明白这一点,就无法明白该实验的“灵魂”……
急性淋巴细胞白血病不同于急性早幼粒细胞白血病和慢性淋巴细胞白血病,它在白血病中也算是一种极为恶性的疾病,是“白血病中的白血病”,这是一种造血系统严重遭到破坏的疾病。在病人基本情况允许下,所有指南推荐的一线治疗方案都是造血干细胞移植,具体来说就是击毁患者原有的造血系统和免疫系统后,输入正常的造血干细胞进行造血系统和免疫系统的重建。
免疫系统和造血系统不分家,比如粒细胞、B细胞、T细胞都是造血干细胞发育而来,只是发育的的场所不同,决定了他们功能不同。
艾滋病是一种免疫系统遭到严重破坏的疾病,它的根治方案,不是维持现有的系统,也应该是重建一个健康的免疫系统。
这就和急性淋巴细胞白血病患者需要进行的治疗方案不谋而合——造血干细胞移植。
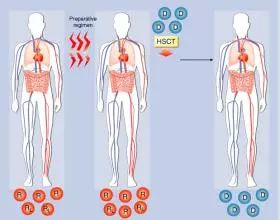
同时,对急性淋巴细胞白血病患者进行本来就需要进行的骨髓移植,免去了招募艾滋病患者的一部分难度,也顺利通过了伦理委员会的审查,说是一箭四雕也不为过。
其次,科学家选择攻克艾滋病的位点是CD4+T细胞上的CCR5受体,这个受体长在CD4+细胞的身上,却叛变了CD4+T细胞,去给艾滋病病毒指路。
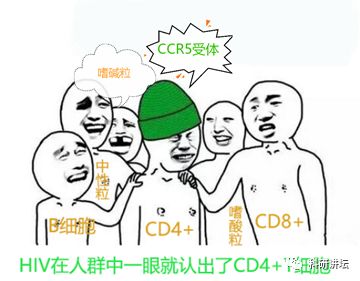
艾滋病破坏免疫系统不是广泛撒网、全面破坏,而是选择T细胞中的CD4+细胞,进行重点攻击。本论文的通讯作者,北京大学邓宏魁教授在1996年即发现,艾滋病病毒攻击CD4+细胞需要“CCR5”这个卧底给它带路。失去这个“CCR5”卧底,艾滋病病毒便失明了,无法分辨人体众多的NK细胞、T细胞、B细胞、中性粒细胞、嗜酸性粒细胞、嗜碱性粒细胞……别说艾滋病病毒了,我都分不清。
这样,艾滋病就陷入了由无数白细胞组成的人民战争的汪洋大海之中。
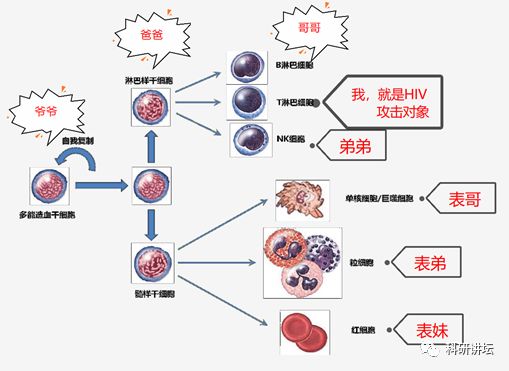
最后,研究中利用的工具是基因编辑第三代技术:CRISPR-Cas9去治疗艾滋病并不是第一次,日本在2018年利用CRISPR/Cas9系统靶向调节T细胞的HIV-1调节基因,降低HIV表达[2]。美国也在感染艾滋病的小鼠中,使用了这项技术,灭活了HIV-1,同时使得转基因小鼠艾滋病病毒基因的RNA表达减少60-70%[3]。可以说,CRISPR-Cas9工具是目前相对成熟的工具,脱靶率比较低,在艾滋病治疗这一块,也确实有前驱细胞实验和动物实验供参考。
从小鼠实验到人体实验是一步惊险的跨越,这个跳跃如果不成功,那么摔坏的不是科学家,而一定是患病的人。邓宏魁教授联合造血干细胞移植大牛陈虎教授3年前就开始制定方案,他们的方案是把经过敲除“奸细”CCR5基因后的造血干细胞输回到患者体内,患者新生长出来的白细胞一律不表达CCR5受体,包括CD4+T细胞,失去了奸细的指引,艾滋病毒彻底失去了攻击目标。截至论文投稿,研究者随访病人达19个月,并对该患者短暂停止服用抗HIV病毒药物,在短暂停药期间,CCR5基因编辑的T细胞表现出一定程度抵御HIV感染的能力,骨髓细胞仍然能够持续检测到CCR5基因编辑片段,也未发现基因编辑造成的脱靶及敲除CCR5基因后导致的其他副作用,重建后的新免疫系统和新造血系统正常运行中。
参考文献:
[1] Xu Lei, WangJun, Liu Yulin et al. CRISPR-Edited Stem Cells in a Patient with HIV and Acute Lymphocytic Leukemia.[J] .N. Engl. J. Med., 2019
[2] Youdiil Ophinniet al. CRISPR/Cas9system targeting regulatory genes of HIV-1 inhibits viral replication ininfected T-cell cultures, Scientific Reports (2018).DOI:10.1038/s41598-018-26190-1
[3] YinChaoran, Zhang Ting, Qu Xiying et al. In Vivo Excision of HIV-1 Provirus bysaCas9 and Multiplex Single-Guide RNAs in Animal Models.[J] .Mol. Ther., 2017,25: 1168-1186.
图源网络
来源:xzlky2015 小张聊科研
原文链接:https://mp.weixin.qq.com/s?__biz=MzAwMzY4MTYxNw==&mid=2655772349&idx=1&sn=27fb7080d143124af68ebf0203bf7db9&chksm=80880283b7ff8b955cd78ccbf01dceee68f62b7c60dd56de5d13ac6259cbceab2165a92f78e9&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

中国科学家首次尝试用基因编辑技术治疗艾滋病
哈佛大学医学院Kucherlapati教授访问中国抗癌协会


利用脐带血干细胞疗法,全球首位女性艾滋病“治愈”者出现
最新研究:干细胞移植或可抑制艾滋病病毒

《自然》年度十大人物邓宏魁:基因编辑干细胞治艾滋病白血病
澳大利亚icon医疗集团访问中国抗癌协会秘书处


第22届全国肿瘤防治宣传周启动仪式在北京举行



中国抗癌协会整合肿瘤学分会成立大会在西安召开




中国首次完成基因编辑干细胞治疗艾滋病和白血病患者
“香蕉艾滋病”蔓延,CRISPR基因编辑成为避免香蕉灭绝的唯一希望


