科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-09-26
来源:BioArt
人类在进食后血糖会急速升高,健康的机体可以通过各种机制降低血糖以维持其在一定的范围内,而最主要的途径是通过胰岛细胞分泌胰岛素,增加机体外周组织对血糖的吸收,从而降低血糖。
胰岛素抵抗表现为胰岛素促进外周组织对葡萄糖摄取和利用的效率降低,与肥胖、糖尿病的发生密切相关。胰岛素-AKT信号可通过多个下游通路来调控葡萄糖代谢。首先,在脂肪和肌肉细胞中,AKT刺激葡萄糖转运道白GLUT4转位上膜,从而增加对胞外葡萄糖的摄取。另外,在肝脏和肌肉细胞中,AKT通过磷酸化GSK3使其失活,从而激活糖原合成酶(GS)促进糖原的合成。AKT还可以通过转录调节抑制糖异生的发生。促进肝脏糖原合成可以有效地降低餐后葡萄糖水平和维持葡萄糖代谢稳态,其中Insulin-AKT-GSK3信号级联被认为是最重要的分子机制。然而,有研究发现在 GSK3α 和β磷酸化位点(AKT磷酸化位点)突变的knock-in小鼠中肝脏糖原积累和血糖浓度都是正常的。这提示着存在不依赖于GSK3的胰岛素刺激下糖原合成的通路,但是其具体机制有待阐述。
2019年9月24日,清华大学李蓬课题组在Cell Reports发表了题为The protein phosphatase 1 complex is a directtarget of AKT linking insulin signaling to hepatic glycogen deposition的研究论文,报道了PP1复合物作为营养感知器,独立于GSK3介导胰岛素刺激下肝脏糖原合成的调节机制。

PP1(protein phosphatase1)对糖代谢具有重要作用,参与调节多个糖原代谢酶活性,包括GS,GP和GPK。PP1全酶由一个催化亚基(PP1c)和一个调节亚基(PPP1R)组成。已知PPP1R3家族作为特殊的一类调节亚基可以把PP1靶向到糖原代谢过程,该家族包括7个成员,PPP1R3a-g。尽管一些研究表明PPP1R3成员参与调节肝脏糖原合成和积累,但是具体的机制究竟是如何呢?
针对这个问题,李蓬团队首先通过生物信息学分析磷酸化蛋白组数据库数据,找到了10个候选蛋白,可能是AKT新的磷酸化底物,同时也参与调节糖脂代谢。随后通过生化实验鉴定出PPP1R3g是AKT一个新的直接底物,同时结合质谱分析发现S79是PPP1R3g的AKT磷酸化位点。其后,课题组发现在胰岛素刺激下PPP1R3g可以直接被AKT磷酸化,更重要的是发现生理和病理条件下的胰岛素信号与PPP1R3g磷酸化水平密切相关。更进一步地,课题组发现在胰岛素刺激下,PPP1R3g介导糖原合成是不依赖于经典的GSK3途径的。接下来,课题组通过敲除和过表达系统在体研究了PPP1R3g磷酸化的生理功能,发现PPP1R3g磷酸化可以加快葡萄糖清除和提高胰岛素敏感性。在机制上,课题组发现PPP1R3g磷酸化可以提升与p-GS的结合,进而加快PP1c对GS的去磷酸化。同时发现了PPP1R3b可作为PPP1R3g的下游,通过结合从PPP1R3g上解离下来的去磷酸化GS,刺激糖原的合成,从而实现对胰岛素信号的传递。
餐后血糖控制紊乱是糖尿病的典型特征,由于胰岛素抵抗,糖尿病患者不能很好地将过多的糖分转化为糖原储存起来,过高的血糖正是各种并发症的罪魁祸首。长久以来,科研工作者一直致力于解决这一问题,然而当GSK3作为靶点的可能性被否定之后,这一领域一度陷入了停滞,而本文发现了PP1复合物能够感知营养状态,从而参与调控胰岛素刺激下的葡萄糖代谢,为这一领域重新带来了曙光。该项研究为改善糖尿病带来的胰岛素抵抗和治疗糖原储存相关疾病提供了新的分子靶点和理论依据。
清华大学生命学院2012级直博生李祺琪为本文第一作者,李蓬教授和徐俐博士为本文的共同通讯作者。
专家点评
陈晓伟(北京大学分子医学研究所研究员)
胰岛素是机体调节血糖吸收、促进合成代谢(anabolic metabolism)最关键的激素,可以促进糖原、脂肪、蛋白质合成。糖原和脂肪可被用于能量贮存;糖原是最先被机体利用的能量储备:比如在运动时,肌肉糖原可以作为快速的能量来源,供肌肉细胞产生ATP;而肝脏中糖原负责在饥饿或能量缺乏时补充血糖,使之维持稳定浓度。
除了上述的生理功能,糖原代谢的异常还会导致多种代谢疾病。糖原代谢的研究最具代表性的是一对传奇的科学夫妇: Carl Cori 和 Gerty Cori。Cori夫妇发现了一系列糖原代谢的生化反应及催化酶,他们的名字被用于命名糖原代谢物(Coriester)、糖原代谢病(Coridisease)、以及肝脏-肌肉糖代谢循环(CoriCycle)。作为少见的诺贝尔奖夫妇,他们在1947年一起获得了诺贝尔生理或医学奖;更难得的是,他们的实验室的成员里至少成长出了另外6位诺贝尔奖获得者。
那么,是不是糖原代谢里,所有的关键问题都已经被解决了呢?糖原代谢里一个长期悬而未决的“灯下黑”问题恰恰是,胰岛素是如何激活糖原合成的?甚至在最新版的Lehninger生化教科书中,还只能以春秋笔法点明需要一个“insulin-sensitive protein kinase”、但不知其身份(图左,蓝框)。
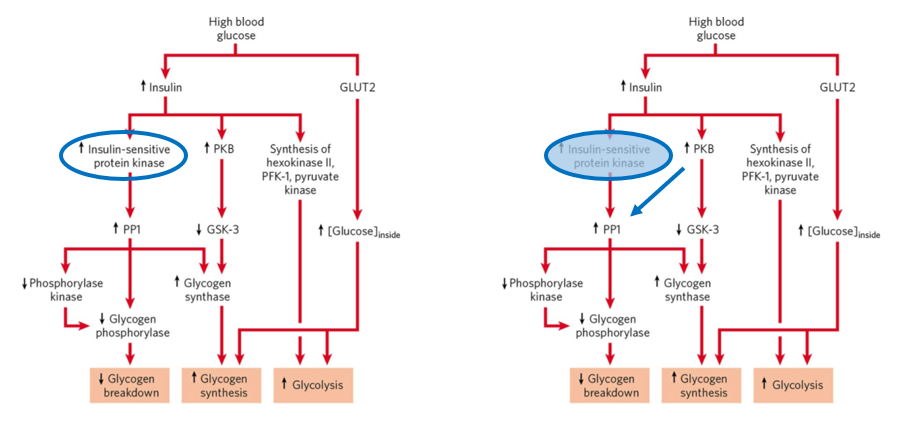
Fig.1 Modified from Lehninger Principlesof Biochemistry, 7th Edition
为何发现这个因子如此困难呢?胰岛素通过磷酸化级联激活一系列蛋白来转递代谢信号。蛋白磷酸化激酶(kinase)和磷酸酶(phosphatase)共同调节;相较于前者,磷酸酶数目很少,其活性也不易被调节。虽然胰岛素可以通过抑制激酶GSK3、降低糖原合成酶GS磷酸化来促进糖原合成,但是这条调节通路的作用非常有限【1,2】。与此相反,胰岛素还通过激活磷酸酶PP1、进而调节多个关键糖原代谢酶。然而,由于对phosphatase调节研究的困难,领域内只能猜测却难以发现这个调节PP1磷酸酶的“insulin-sensitive protein kinase”。本工作鉴定出这个激酶恰恰是胰岛素信号的关键激酶AKT/PKB,通过磷酸化PP1的调节亚基PPP1R3g来控制PP1活性及糖原代谢,从而在教科书原先的图里,画上了一个新的箭头(图右,蓝色)。
读完本研究后,既让人有“众里寻他千百度”之后的惊喜,又感到“千呼万唤始出来”的不易:一方面,这个激酶竟然就是领域中熟知的AKT/PKB,进而说明AKT既需要抑制GSK3这个磷酸化的writer,又要激活PP1来erase已有的磷酸化,潜在提示了大家要重新审视此前多集中于激酶的信号转导研究;另一方面,这个研究也告诉我们,经典的领域永远不会过时、哪怕常常被人忽视。There is no old science, only old wisdom.
原文链接:
https://doi.org/10.1016/j.celrep.2019.08.066
参考文献
1. Cross, D.A., Alessi, D.R., Cohen, P., Andjelkovich,M., and Hemmings, B.A. (1995). Inhibition of glycogen synthase kinase-3 byinsulin mediated by protein kinase B. Nature378, 785-789.
2. Wan, M.,Leavens, K.F., Hunter, R.W., Koren, S., von Wilamowitz-Moellendorff, A., Lu,M., Satapati, S., Chu, Q., Sakamoto, K., Burgess, S.C., Birnbaum MJ. (2013). Anoncanonical, GSK3-independent pathway controls postprandial hepatic glycogendeposition. Cell Metab 18, 99-105.
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652475706&idx=2&sn=0ac7a8190c49b5442fce41411a2c8b8d&chksm=84e2028eb3958b985968cd0ab32804eaccf7823876c19acf5bfe613e7df30af8eaf06d6b1207&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

绘制拟南芥转录组、蛋白质组和磷酸化修饰组图谱,蛋白质丰度与翻译后修饰等研究

华中农大邱宁组揭示糖基化/磷酸化在禽蛋蛋白质生物功能和食品特性上的作用

中国科学院遗传发育所在植物磷酸化蛋白质组学技术研发方面获进展
新冠病毒侵染的磷酸化蛋白质组全景图
趣味科学:仰卧起坐会导致瘫痪,这是真的吗?
石远凯:探索抗癌新药

化学小分子诱导靶标蛋白质去磷酸化
Dev Cell :刘延盛组发现磷酸化修饰对蛋白质表达稳定性的影响
论文导读——单细胞空间转录组分析、磷酸化蛋白质组功能性景观数据库
真相:桃子和西瓜一起吃有剧毒?谣言卷土重来,你又信了?