科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-08-17
内容来源:上海交通大学
原标题:上海交通大学系统生物医学研究院陶生策课题组基于蛋白质芯片发现细菌蛋白质去乙酰化CobB与原核第二信使c-di-GMP间的双向调控通路
2019年8月17日,生物化学领域知名期刊The EMBO Journal在线发表上海交通大学系统生物学研究院陶生策课题组最新研究成果Interplay between the bacterial protein deacetylase CobB and the second messenger c-di-GMP,该研究揭示了细菌去乙酰化酶CobB和原核第二信使分子c-di-GMP在体内的相互调控关系。该研究分两个层面:1. 首次发现c-di-GMP与CobB有较强结合并通过结合调控CobB的蛋白质去乙酰化酶活性, 2. 进一步发现c-di-GMP的一个重要合成酶DgcZ的乙酰化可被CobB特异去除,乙酰化的去除可改变DgcZ的活性,从而调控细胞内c-di-GMP的水平。

环二鸟苷酸cyclic di-GMP / c-di-GMP是在细菌中广泛存在的第二信使分子,于1987年由Moshe Benziman等在醋酸纤维杆菌中首次发现,迄今为止,已经发现了c-di-GMP在细菌运动、生物膜形成、毒力以及转录调控等方面发挥重要作用。作为第二信使分子,c-di-GMP可以全局性地调控细菌的生理过程,但是其与能量代谢通路的关系至今仍未知。
CobB是细菌中第一个被发现的蛋白质去乙酰化酶,属于Sir2家族去乙酰化酶,在原核生物中高度保守。CobB可广泛地调控细菌的生理功能,如乙酰辅酶A合成、细菌趋化性运动以及DNA解螺旋等。但是,细菌体内调控CobB活性的因子却极少有报道。
在本研究中,首先,研究人员利用大肠杆菌蛋白质组芯片(包含4016种大肠杆菌所编码的蛋白质),发现c-di-GMP与CobB具有较强的相互作用。进一步的体内实验表明,在大肠杆菌中c-di-GMP通过结合抑制CobB的去乙酰化酶活性进而调控CobB-Acs-CoA途径中乙酰辅酶A的最终合成。通过位点突变实验,发现c-di-GMP结合在CobB N端的R8,R17以及E21 等3个氨基酸残基上。通过序列比对发现,这三个位点在原核生物中广泛保守。紧接着,研究人员选择沙门氏杆菌的CobB进行验证,结果显示c-di-GMP同样能够结合并抑制沙门氏杆菌CobB的活性,这些结果表明c-di-GMP对CobB的调控很可能在原核生物中广泛存在。
其次,本研究还发现大肠杆菌的一个关键c-di-GMP合成酶DgcZ在体内能够被乙酰化,且CobB可通过去除DgcZ K4位点的乙酰化而提高DgcZ的活性,并进而调控胞内c-di-GMP的水平。在分子机制方面,研究人员发现DgcZ K4的乙酰化可导致其多聚和沉淀,而CobB的去乙酰化能够促进DgcZ蛋白的稳定性。
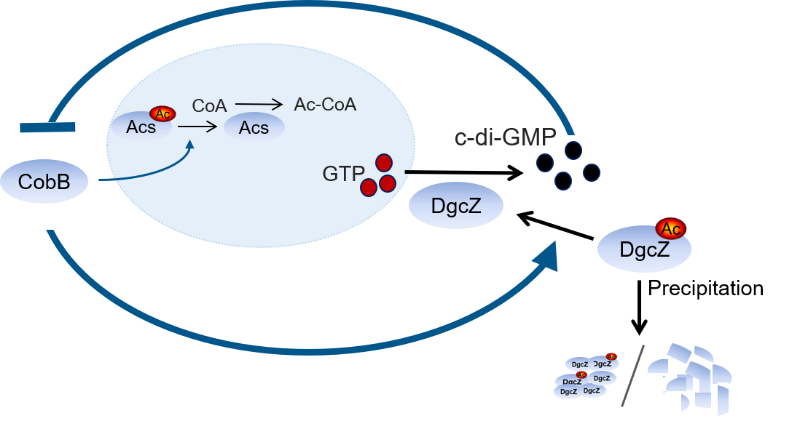
综上所述,本研究揭示了细菌去乙酰化酶CobB和第二信使c-di-GMP的相互调控,在体内形成了一个负反馈调节通路,为c-di-GMP研究提供了全新的效应蛋白,也为CobB在体内的调控因子提供新的证据。本研究再次展示了蛋白质芯片在新型功能发现研究方面的高效性和有效性。
本项研究的共同第一作者是上海交通大学博士研究生许钊葳、博士后张海南和清华大学博士研究生张行润。本研究的合作者包括清华大学李海涛教授,中科院上海药物所谭敏佳研究员,以及上海交通大学生物医学工程学院Daniel M. Czajkowsky教授。上海交通大学系统生物医学研究院陶生策研究员为通讯作者。
本研究得到了十三五国家重点研发计划蛋白质机器与生命过程调控项目,以及国家自然科学基金等项目的资助。
全文链接:https://doi.org/10.15252/embj.2018100948
作者:许钊葳供稿单位:系统生物医学研究院来源:上海交通大学
原文链接:https://news.sjtu.edu.cn//jdzh/20190820/108889.html
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn