科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-02-26
原标题:许超课题组与合作者在《eLife》发文揭示SETD3蛋白作为β-actin组氨酸甲基化酶的结构与功能
近日,中国科学技术大学许超教授课题组与波兰华沙大学Jakub Drozak实验室合作,解析了SETD3与β-actin多肽的高分辨复合物晶体结构,并结合酶活实验揭示了肌动蛋白(Actin)第73位组氨酸(His73)的N3位甲基化的作用机制,相关成果以“Structural insights into SETD3-mediated histidine methylation on β-actin”2月20日在线发表于《eLife》杂志。
细胞骨架主要有微管、微丝和中间纤维三种成分,其中微丝在细胞形态维持、细胞的运动、细胞内物质运输等细胞内重要生命活动中发挥作用。微丝主要由Actin通过聚合形成,Actin高度保守,是一类可以结合并水解ATP的蛋白质,β-Actin蛋白质第73位组氨酸甲基化于五十多年前就被发现在绝大多数真核细胞中广泛存在,并通过Actin水解ATP后延迟释放ADP,来调控微丝聚合及功能。
SETD3是SET结构域超家族成员,其过表达与癌症的恶行化密切相关,在以往报导中被认为可以作为赖氨酸甲基化酶而发挥功能。本研究鉴定出SETD3与β-actin小肽的相互作用,并通过质谱发现SETD3特异甲基化含有His73的β-actin片段,通过解析了SETD3与β-actin片段的复合物结构,结合一系列酶活测定,揭示了SETD3特异识别β-actin底物并甲基化其His73的分子机制,阐释了SETD3作为SET家族的特殊成员,具备组氨酸甲基化而非赖氨酸甲基化酶活性的机制。该结构的解析,为将来靶向SETD3的小分子设计提供了结构基础。
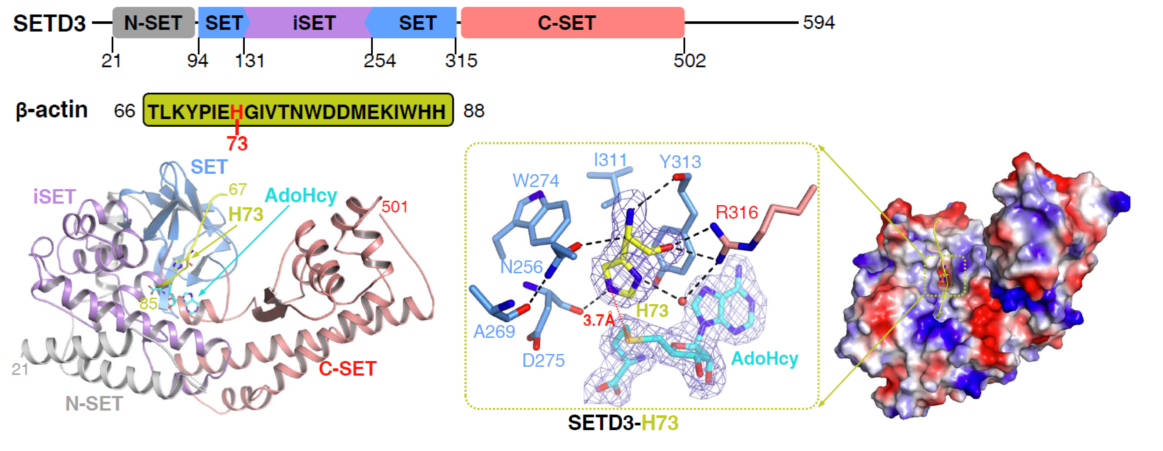
SETD3与β-actin片段的晶体结构,其中SETD3通过特殊口袋识别并催化β-actin第73位组氨酸
本文的第一作者为许超课题组博士生郭琼、特任副研究员廖善晖及Jakub Drozak课题组的Sebastian Kwiatkowski,许超教授、Jakub Drozak教授及廖善晖特任副研究员为共同通讯作者。
该工作获得了基金委、微尺度国家研究中心及中组部的支持。
论文链接:https://elifesciences.org/articles/43676
内容来源:中国科技大学合肥微物质研究中心来源:中国科技大学合肥微物质研究中心
原文链接:http://www.hfnl.ustc.edu.cn/detail?id=15509
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn