科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-11
来源:BioWorld
早在1981年,Lancet 基于临床观察,敏锐地率先提出了“铁源性心脏病”这一重要医学命题。
三十余年后,铁死亡(Ferroptosis)概念的提出与深入研究,为揭示微量元素铁在心脏疾病发生发展中的分子病理机制敲开了至关重要的突破口。
近日,在《科学通报》2019年第28-29期,浙江大学医学院王福俤教授团队发表题为“铁过载及铁死亡在心脏疾病中的研究进展”的封面文章,系统总结了国内外铁过载与铁死亡对心脏病发病的影响及作用机制的最新研究进展,并用上古神话“女娲补天”形象展示铁死亡与心脏疾病防治的转化研究及临床应用[1]。

图1:女娲补天 |《科学通报》2019年第28-29期封面
1
铁代谢紊乱与心脏疾病关系密切
铁是机体必需的微量元素之一,在维持机体健康中发挥极为重要的作用。一方面,缺铁性贫血至今仍严重威胁全球人类健康;另一方面,过多的铁离子可促进自由基的形成,从而对细胞产生毒性。正是铁离子“双刃剑”的特性,机体在进化过程中逐渐形成并完善了一整套维持铁代谢平衡的复杂精细调节系统,可以既满足生理需求,同时避免铁过载造成的危害。
心脏损伤是铁过载产生的严重后果之一。遗传性血色病是人体多个器官大量铁沉积并导致功能障碍为主要特征的常染色体隐性遗传疾病。据美国梅奥诊所(Mayo Clinic)的研究报道,约有1/3的血色病患者死于心脏病[2],而祛铁治疗可以有效降低心脏病的发病率,同时显著改善预后[3]。此外,β地中海贫血、骨髓增生异常综合征等患者由于需要长期反复的输血治疗,也很容易造成机体内铁的逐渐累积。慢性铁过载诱发的左心室功能障碍及肺动脉高压是地贫患者死亡的首要原因,约占2/3[4]。
随着社会经济水平的不断提高和物质文明的快速发展,许多发达国家与地区中铁营养的核心问题已经从铁缺乏转变为铁过剩,并由此导致了包括心脏疾病在内的诸多重大慢病。王福俤团队前期的系列荟萃分析研究发现,膳食血红素铁的摄入与心脏疾病风险显著相关,且呈现出明显的剂量反应关系,即血红素铁的膳食摄入每天增加1毫克,发生心脏疾病的风险增加7%[5]。
2
铁死亡理论的横空出世
2012年,美国哥伦比亚大学的研究人员首次报道了一种新的程序性细胞死亡方式,即铁死亡。经过大量研究,证实铁离子螯合剂可有效抑制该类型细胞死亡,而凋亡、坏死、自噬抑制剂没有效果,表明铁离子在这种新型的细胞死亡过程中发挥了重要作用,并由此将这种铁依赖(Iron-dependent)的细胞死亡方式命名为Ferroptosis(铁死亡)[6]。
铁死亡在细胞形态学、遗传学以及生物化学等方面与已知的其他细胞死亡方式均有明显的不同,其主要特征表现为细胞死亡过程中伴随着大量的铁离子累积和脂质过氧化。尽管铁死亡的生理作用还有待阐明,但已有众多证据提示,铁死亡广泛参与肿瘤、神经退行性疾病、脑卒中、肾损伤等多种疾病的发生发展,且机制复杂[7]。其中,王福俤教授团队发现铁死亡在血色病及铁过载肝脏损伤中的重要作用,并进一步揭示Slc7a11是调控铁死亡的关键基因,成果发表在2017年Hepatology 期刊[8]。
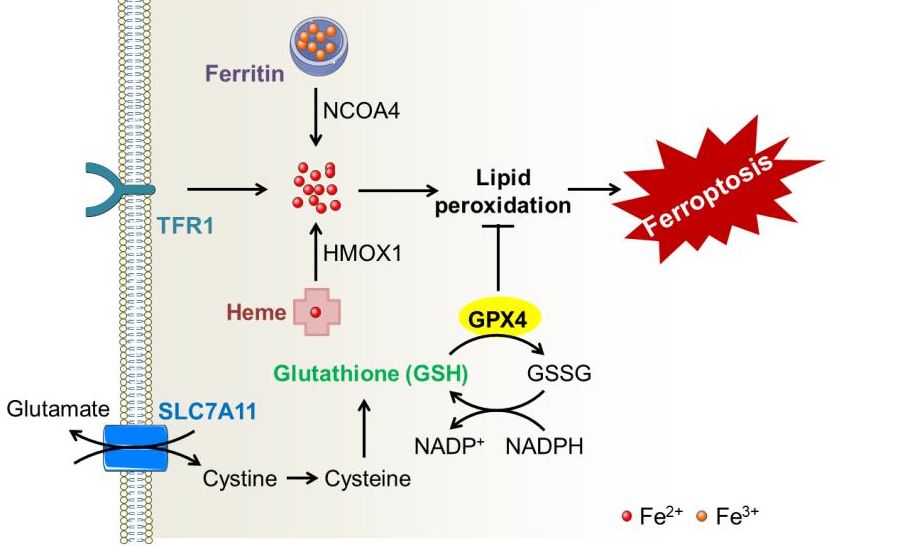
图2:铁死亡发生与调控的分子机制
3
铁死亡是心脏疾病的重要机制
虽然人们从未停止过探索铁过载引发的心脏损伤机制, 但长期以来尚无公认结论。铁死亡概念的提出,为这一关键科学问题的解决带来了新的曙光。王福俤团队通过多种细胞死亡抑制剂处理结合细胞死亡通路相关基因敲除小鼠发现,铁死亡特异抑制剂Ferrostatin-1(Fer-1)可显著降低阿霉素导致的心脏毒性并提高小鼠的存活率。为了寻找阿霉素心肌病模型中铁死亡发生过程的关键调控因子,研究团队通过RNA-seq发现:血红素加氧酶-1(Hmox1)的显著上调可能参与其中。Hmox1的激活介导自由铁离子从血红素中释放出来,蓄积在心肌细胞从而诱发了铁死亡。进一步的研究证实铁蓄积和铁死亡的过程在阿霉素作用后主要发生在心肌细胞的线粒体中。此外,给予铁死亡抑制剂同样可以明显减轻缺血再灌注导致的心脏损伤,为临床心肌梗死等心脏疾病的防治提供了极有前景的新思路和新策略,成果发表在今年Proc Natl Acad Sci USA(PNAS) 期刊[9]。
王福俤团队2019 PNAS 研究发表后,国际铁死亡研究权威、德国亥姆霍兹研究中心Marcus Conrad教授在知名学术期刊Cell Research 发表专题点评,认为这是“第一次将心肌细胞死亡的机制在体内水平联系到铁死亡”,高度评价了该重要发现[10];心血管研究领域顶级期刊Circulation 采访了王福俤教授,并以“New Target to Protect Against Cardiomyopathy”为题发表于 “The Pulse”重要新闻版块 [11]。
4
总结
铁是最早被人类认识的生命必需微量元素,而铁死亡作为最“年轻”的程序性细胞死亡类型,相关研究刚刚起步。铁代谢失衡及铁死亡极大地参与了心脏疾病的发生发展,而线粒体是启动心脏铁死亡的主要细胞器。
铁死亡抑制剂、祛铁剂、线粒体特异性抗氧化剂、Hmox1抑制剂以及低铁膳食等五种策略如同“女娲补天”传说中的“五色神石”一般,挽狂澜于既倒,扶大厦之将倾,成功防治阿霉素导致的心脏损伤,这一里程碑式的重要发现不仅指明了将来的研究方向,同时使我们对铁死亡研究的临床转化充满信心。铁过载以及铁死亡是心脏疾病的关键病理分子机制,靶向铁过载和铁死亡给心脏疾病的防控带来无限曙光。
参考文献
[1] 方学贤, 蔡昭贤, 王浩, 闵军霞, 王福俤. 铁过载及铁死亡在心脏疾病中的研究进展. 科学通报. 2019, 64:2974-2987.
[2] Olson LJ, Edwards WD, McCall JT, Ilstrup DM, Gersh BJ. Cardiac iron deposition in idiopathic hemochromatosis: histologic and analytic assessment of 14 hearts from autopsy. J Am Coll Cardiol.1987;10(6):1239-43.
[3] Gaenzer H, Marschang P, Sturm W, Neumayr G, Vogel W, Patsch J, Weiss G. Association between increased iron stores and impaired endothelial function in patients with hereditary hemochromatosis. J Am Coll Cardiol.2002;40(12):2189-94.
[4] Borgna-Pignatti C, Cappellini MD, De Stefano P, Del Vecchio GC, Forni GL, Gamberini MR, Ghilardi R, Piga A, Romeo MA, Zhao H et al. Cardiac morbidity and mortality in deferoxamine- or deferiprone-treated patients with thalassemia major. Blood.2006;107(9):3733-7.
[5] Fang X, An P, Wang H, Wang X, Shen X, Li X, Min J, Liu S, Wang F. Dietary intake of heme iron and risk of cardiovascular disease: a dose-response meta-analysis of prospective cohort studies. Nutr Metab Cardiovasc Dis.2015;25(1):24-35.
[6] Dixon SJ, Lemberg KM, Lamprecht MR, Skouta R, Zaitsev EM, Gleason CE, Patel DN, Bauer AJ, Cantley AM, Yang WS et al. Ferroptosis: an iron-dependent form of nonapoptotic cell death. Cell.2012;149(5):1060-72.
[7] Stockwell BR, Friedmann Angeli JP, Bayir H, Bush AI, Conrad M, Dixon SJ, Fulda S, Gascon S, Hatzios SK, Kagan VE et al. Ferroptosis: A Regulated Cell Death Nexus Linking Metabolism, Redox Biology, and Disease. Cell.2017;171(2):273-85.
[8] Wang H, An P, Xie E, Wu Q, Fang X, Gao H, Zhang Z, Li Y, Wang X, Zhang J et al. Characterization of ferroptosis in murine models of hemochromatosis. Hepatology.2017;66(2):449-65.
[9] Fang X, Wang H, Han D, Xie E, Yang X, Wei J, Gu S, Gao F, Zhu N, Yin X et al. Ferroptosis as a target for protection against cardiomyopathy. Proc Natl Acad Sci U S A.2019;116(7):2672-80.
[10] Conrad M, Proneth B. Broken hearts: Iron overload, ferroptosis and cardiomyopathy. Cell Res. 2019;29(4):263-264.
[11] Hampton T. New target to protect against cardiomyopathy. Circulation. 2019; 139:2278-2279.
来源:ibioworld BioWorld
原文链接:http://mp.weixin.qq.com/s?__biz=MzU1MzMxMzcyMg==&mid=2247493903&idx=8&sn=de8bcfba33c76f92ce5ab0c1cba1f714&chksm=fbf61ddacc8194cc993d103879042c2ace81f45da0e9950b25bb4a4fb288c5059608ba34cef3&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

王福俤/闵军霞/谢黎炜团队合作揭示转铁蛋白受体调控脂肪细胞产热及细胞命运的新机制

大会专辑|2018生物物理大会生物微量元素分会场回顾
【科技前沿】王福俤团队特邀综述(封面):金属转运蛋白SLC39A14生理功能及作用机制研究进展

靶向铁死亡防治心脏疾病
王福俤/闵军霞/谢黎炜团队合作揭示转铁蛋白受体调控脂肪细胞产热及细胞命运的新机制

【科技前沿】铁与金的生死博弈,浙江大学王福俤团队等在铁死亡领域再获新突破

浙大王福俤/闵军霞团队等发布全球最大新冠肺炎重症及死亡风险荟萃分析

STTT:铁与金的生死博弈,浙江大学王福俤团队等在铁死亡领域再获新突破

铁与金的生死博弈,浙江大学王福俤团队等在铁死亡领域再获新突破

【科技前沿】王福俤/闵军霞/郑树森院士团队在肝纤维化及肝硬化防治领域获得重大突破