科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-17
来源:逻辑神经科学
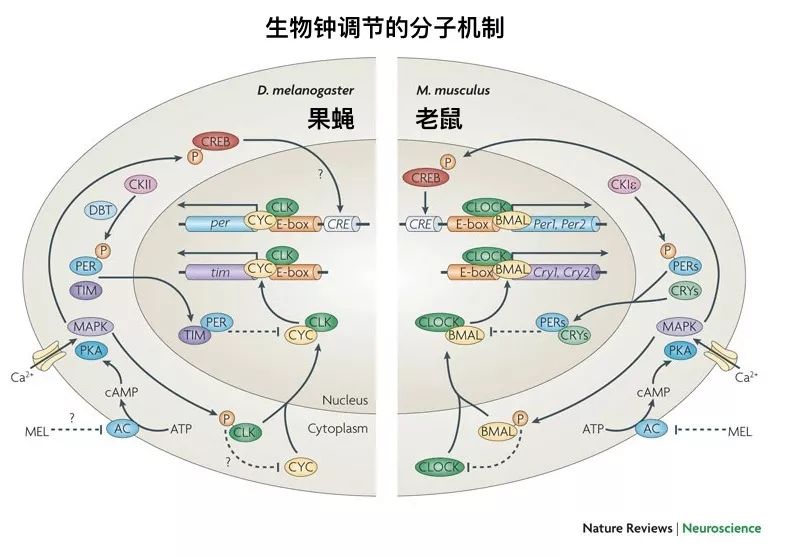
在全天范围内,生物钟(/昼夜节律)驱动蛋白质的磷酸化(circadian clock–driven protein phosphorylation)是将周围组织(peripheral tissues)的生物过程进行时间间隔的关键机制【1-2】。据报道,在大脑中,有几种蛋白质的磷酸化与睡眠压力相关,而睡眠压力本身是受昼夜节律所调节的【3-4】。在神经元局部区域内,磷酸化在突触功能的调节中起着关键作用,这一过程是通过蛋白质活动的快速调节来实现的。因此,可以根据昼夜节律或睡眠驱动因素来动态地调整突触强度【5-6】。所以,系统地了解突触蛋白质磷酸化动力学的级别和起源,对于评估突触功能的缺陷和了解大脑病理的时间变化具有重要意义。
对于突触内全面的磷酸化信号是否以及如何以时间依赖的方式所形成的,我们对其知之甚少。因此,为了全面揭示昼夜节律和睡眠依赖条件下的突触内磷酸化节律(phosphorylation rhythms),Franziska Brüning(第一作者,[1](德国)慕尼黑大学医学院医学心理研究所 & [2](德国)马普生物化学研究所蛋白质组学与信号转导系)、Sara B. Noya(共同第一作者,[3](瑞士)苏黎世大学药理学和毒理学研究所)、Steven A. Brown(第一通讯作者,同[3])、以及Maria S. Robles(第二通讯作者,同[1] )等人采用生物化学方法从小鼠前脑分离突触神经小体(synaptoneurosomes),并使用先进的基于质谱的蛋白质组学方法对其进行了分析。研究揭示出,在突触磷酸化动力学中,睡眠和醒来的压力都起着主导作用;而且,这些动态显著影响了突触功能和下游调控网络【7】。
这项重要研究成果已于2019年10月11日以Sleep-wake cycles drive daily dynamics of synaptic phosphorylation为题在线发表在Science(最新IF=41.037)【7】。

首先,Franziska Brüning等人发现,在超过2000个蛋白质中,有超过8000个磷酸肽在突触神经节腔室中被精确定量,而且,24小时内,有30%的磷酸肽的含量变化较大。其次,研究表明,节律性磷酸肽的相位(The phases of rhythmic phosphopeptides)分布主要集中于两个类群中,分别对应着黎明从觉醒到睡眠和黄昏从睡眠到觉醒的转变(下图)。
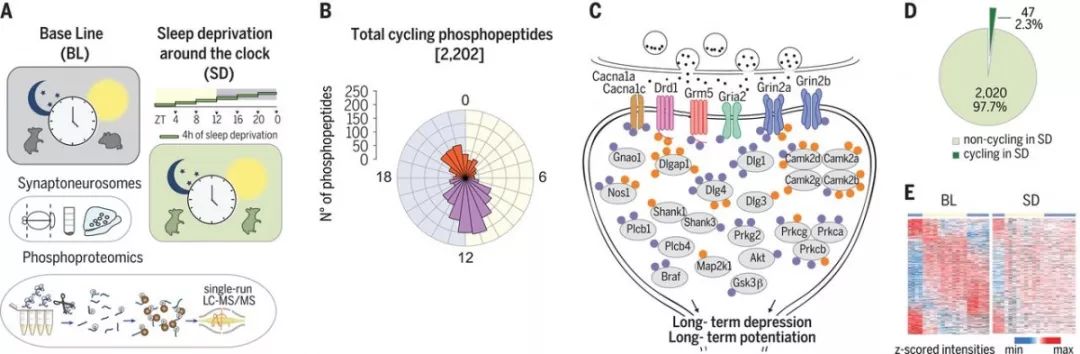
Daily dynamics of global phosphorylation in forebrain synaptoneurosomes under basal and sleep-deprived conditions. (A) Quantitative phosphoproteomicsanalyses of isolated synaptoneurosomes from rested and sleep-deprived mice around the clock. (B and C) More than 30% of phosphorylations in manysynaptic components and numerous kinases cycle daily with peaks at the sleep-wake-sleep transitions. (D and E) Sleep deprivation abolished 98% of allphosphorylation cycles in synaptoneurosomes
研究者们进一步发现,除了离子通道、受体、支架等重要的突触成分外,大量的激酶也存在于经磷酸化调控的突触蛋白中,且具有时间依赖性。另外,超过半数的突触磷酸化激酶在一个或多个残基上表现出有节律的磷酸化。实验进一步表明,在突触中,广泛的激酶活性动态调控是一个极其重要的磷依赖性功能过程(上图)。
总的来说,Franziska Brüning等人揭示了突触的分子过程,其活动是由磷酸化控制的,比如在黎明时的突触抑制和黄昏时的突触兴奋。通过在一天内的不同时间实施4小时的睡眠剥夺来干扰睡眠(休息)-觉醒(活动)周期,研究者进一步评估了昼夜节律和睡眠驱动信号;睡眠不足导致了98%的前脑突触的节律性磷酸化的缺失;而在突触运输和支架作用的41个磷酸蛋白中,昼夜节律周期不受影响。因此,他们推测磷酸化介导的突触信号的调控可能是睡眠和清醒依赖机制下调节突触稳态和功能的关键驱动因素。
文献参考
【1】D. Mauvoisin et al., Circadian clock-dependent and-independent rhythmic proteomes implement distinct diurnal functions in mouse liver. Proc. Natl. Acad. Sci. U.S.A. 111,167–172 (2014).
【2】M. S. Robles, J. Cox, M. Mann, In-vivo quantitative proteomics reveals a key contribution of post-transcriptional mechanisms to the circadian regulation of liver metabolism. PLOS Genet.10, e1004047 (2014).
【3】M. S. Robles, S. J. Humphrey, M. Mann, Phosphorylation is a central mechanism for circadian control of metabolism and physiology. Cell Metab. 25, 118–127 (2017).
【4】J. J. Liu et al., In vivo brain GPCR signaling elucidated by phosphoproteomics. Science 360, eaao4927 (2018).
【5】G. H. Diering et al., Homer1a drives homeostatic scaling-down of excitatory synapses during sleep. Science 355, 511–515(2017).
【6】S. B. Noya et al., The forebrain synaptic transcriptome is organized by clocks, but its proteome is driven by sleep. Science 366, eaav2642 (2019)
【7】Brüning et al., Sleep-wake cycles drive daily dynamics of synaptic phosphorylation Science 366, eaav3617 (2019)
来源:LT-Neuroscience 逻辑神经科学
原文链接:http://mp.weixin.qq.com/s?__biz=MzI4Mjk3NzUxOQ==&mid=2247485257&idx=2&sn=234a3e2a5d3920512d083e86bf16a818&chksm=eb90f2c9dce77bdf3e2b257b31e2c3da42e58fbfb48065c32bf9489cb77d33040c37afb30345&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
新冠病毒侵染的磷酸化蛋白质组全景图
中国睡眠研究会参加2015年科技周活动




血清素在睡眠中的作用终于搞清了
通告
论文导读——单细胞空间转录组分析、磷酸化蛋白质组功能性景观数据库
2015年度睡眠呼吸疾患新进展学术会议学分证书领取通知

中国科学院遗传发育所在植物磷酸化蛋白质组学技术研发方面获进展

华中农大邱宁组揭示糖基化/磷酸化在禽蛋蛋白质生物功能和食品特性上的作用
气候变化将带七种惊人影响,人类性生活或减少




化学小分子诱导靶标蛋白质去磷酸化