科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-18
来源:BioArt
黄病毒属包含众多严重威胁人类健康的病原,如登革病毒、寨卡病毒、黄病毒、日本脑炎病毒、西尼罗病毒等。登革病毒经蚊虫传播,感染人群后可引起类似流感的轻微症状,如发热、头痛、肌肉痛、关节痛(登革热),也可引发登革出血热及登革热休克综合症等致命性疾病。在没有医疗干预的情况下,登革病毒感染可造成多达20%的重症登革热患者死亡。
目前,全世界40%的地区面临登革热感染风险,每年约有3.9亿人感染。随着全球变暖、人口流动,这一威胁日益严重。登革热在我国海南、广东、福建、江西、台湾等地流行。2018年,登革热被世界卫生组织(WHO)入选为全球卫生面临的10项威胁之一。
目前,赛诺菲巴斯德开发的四价减毒活疫苗Dengvaxia已获批在巴西、墨西哥等国使用。但是,该疫苗的使用效果不佳;而且,未接触过登革病原的儿童在注射该疫苗后,如果被登革病毒感染,将面临病情加剧的风险。
为此,WHO建议仅在登革热高发的疫区使用该疫苗。另外,虽然多年来各大制药企业及研究机构致力于抗病毒药物的研发,但是目前临床上仍然没有任何药物可以用来治疗登革病毒感染。因此,深入理解登革病毒复制及组装等环节的分子机制,将有助于新型疫苗及抗病毒药物的研发。
病毒组装是病毒生命周期必不可少的环节。黄病毒的组装不仅需要病毒基因组和衣壳蛋白(C)、膜蛋白prM及包膜蛋白(E)等结构蛋白,也需要NS2A、NS1、NS2B和NS3等非结构蛋白的辅助。目前,对于黄病毒组装的许多细节,如病毒核衣壳(C蛋白和基因组RNA的复合物)如何形成、核衣壳如何被病毒外壳(由病毒蛋白prM和E及脂质双分子层组成)包裹、非结构蛋白如何调控病毒组装等,我们知之甚少。
2019年10月17日,美国得克萨斯大学医学分部史佩勇团队在Cell Host & Microbe杂志上发表了标题为Dengue NS2A protein orchestrates virus assembly的长文文章,揭示了黄病毒组装的重要细节。

蛋白前体(C-ancorC-prM)的有序切割是保障黄病毒高效组装的先决条件。研究人员通过分子生物学的方法,发现病毒NS2A蛋白的一个点突变(G11A)可导致病毒在哺乳动物细胞中组装功能的完全丧失,但并不影响病毒RNA的合成(图1)。
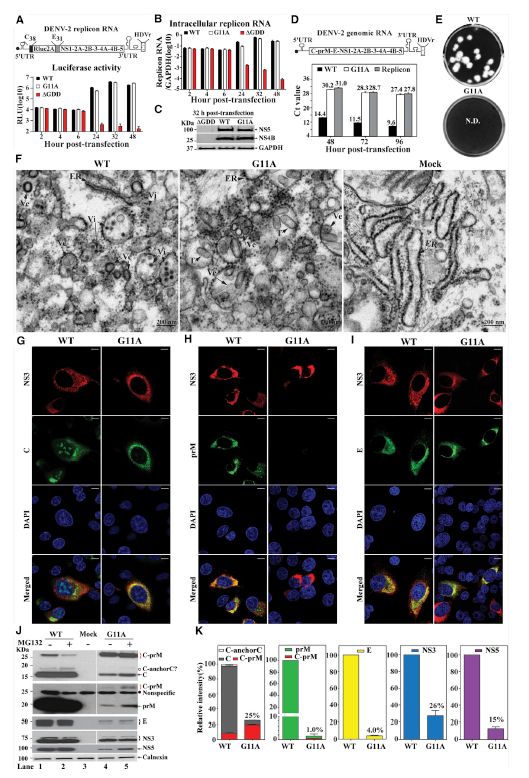
图1. NS2A 点突变G11A 导致C-anchorC 无法切割、结构蛋白C、prM 和E的表达或定位改变,病毒组装无法完成
深入研究发现,该突变特异性地增强了蛋白NS2A与prM的相互作用,引起了prM构象改变,并迫使prM氮端的先导信号肽(anchorC)向内质网膜内移动。这一构象上的移动使得位于C和anchorC链接处的蛋白酶切割位点被内质网膜掩盖,从而阻碍了病毒蛋白酶NS2B-3在该处的切割 (图2),进而改变了病毒C、prM和E结构蛋白在细胞内的表达和定位,最终导致病毒组装无法完成。通过更精细的突变方法,研究人员证实G11A可导致anchorC向膜内移动两个氨基酸的距离。重要的是,类似的作用机制同样发生于病毒感染的蚊虫细胞中。
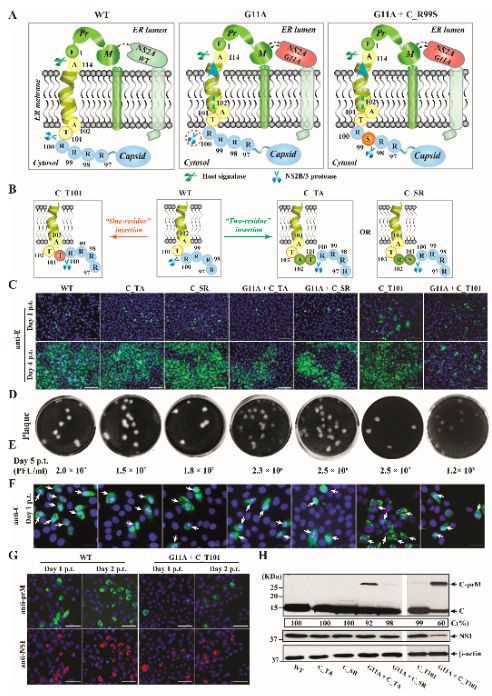
图2. NS2A 点突变G11A引起anchorC向内质网膜内移动了两个氨基酸,影响了C-prM的切割
随后,为了理解病毒RNA如何被包装进入病毒颗粒,研究人员深入研究了病毒RNA与NS2A的相互作用。通过系列的RNA-蛋白结合及PAR-CLIP实验,作者发现NS2A可特异性结合位于病毒基因组端的3ʹ端(3ʹUTR)的最后285个非翻译核苷酸序列。
而且,NS2A中位于胞质侧的肽段(93-100)序列对于NS2A和3ʹUTR的相互作用至关重要。突变该肽链中的三个带电氨基酸(R94, K95, K99)可显著性削弱NS2A和3ʹUTR的相互作用,同时导致病毒组装缺陷。
最后,研究人员提出了黄病毒的组装模型 (图3)。在病毒复制晚期,NS2A结合到新和成的病毒正义链RNA 3ʹUTR的上,将病毒RNA从病毒复制复合体(Replication complex)导向病毒包装区域(Assembly site)。
此外,NS2A通过结合prM和NS3蛋白,将C-prM-E蛋白前体和蛋白酶NS2B-3招募至该包装区域。随后,蛋白酶NS2B-3率先将C-prM-E切割成成熟的C和anchorC-prM,后者进而被宿主信号肽酶切割,产生成熟的prM 蛋白。
成熟的C蛋白结合病毒基因组RNA形成核衣壳。成熟prM蛋白与E蛋白结合并多聚化。在此多聚化的过程中,核衣壳被由prM/E及内质网膜组成的外壳包裹,产生病毒颗粒。该研究架构了黄病毒组装的新模型,并为抗病毒药物研究提供了新思路。
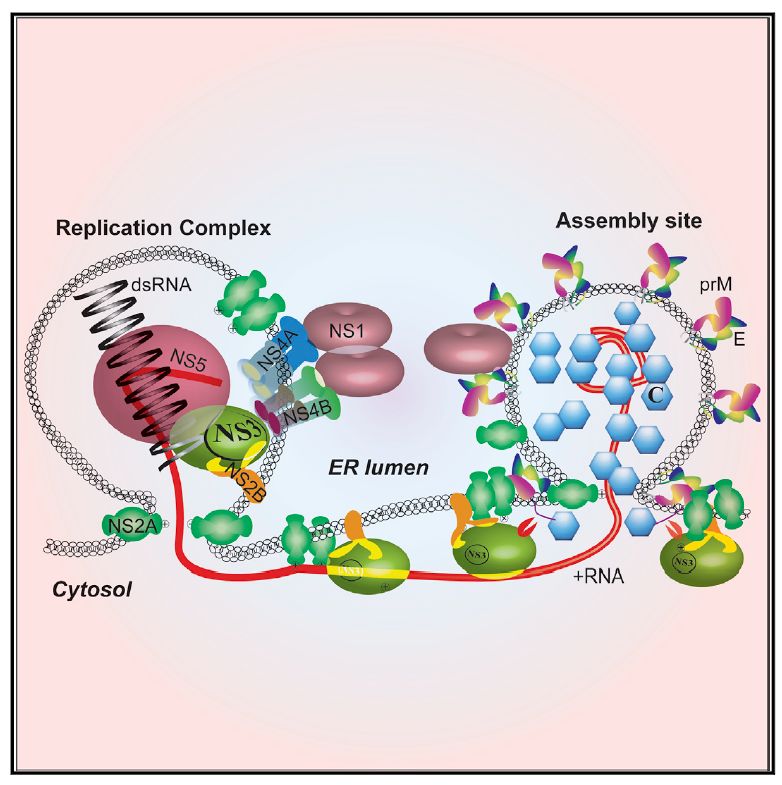
图3. 黄病毒的组装模型
史佩勇团队博士后谢旭平博士为论文的第一作者和共同通讯作者;史佩勇教授为论文的另一共同通讯作者。
史佩勇教授现为美国微生物学院士。其团队长期从事黄病毒的基础和转化研究,在黄病毒反向遗传学系统建立、减毒活疫苗研发、血清学检测、药物筛选、致病性研究等方面取得了突出成就,在Nature、Cell、Science、Nature Medicine、Immunity、Cell Host & Microbe、Cell Research、Nature Communications、PLoS Pathogen、Journal of Clinical Investigation、Nucleic Acids Research、Cell Reports、Ebiomedicine、MBio、Journal of Medicinal Chemistry、Elife、Antiviral Research、Journal of Virology等期刊累计发表文章200多篇,累计引用次数17561(by Google scholar)。
原文链接:
https://doi.org/10.1016/j.chom.2019.09.015
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652476714&idx=4&sn=050831a76605632f7d71a37f18f3def6&chksm=84e2069eb3958f8862b3de347f4e011cc2bf6d0463800247c2968f7256028ec62bf8887f40d3#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
蚊子,消灭登革热靠你了!
登革热或加重寨卡病情

限制全球变暖可以避免数百万的登革热

防蚊灭蚊,预防登革热!

活动预告丨“CAAI进校园”系列活动走进电子科技大学

简单三招远离登革热!

简单三招远离登革热!

蚊子都笑了——登革热科普
简单三招远离登革热!
浙大34岁“歌神教授”:科研也是在创造艺术品


