科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-23
来源:BioArt植物
原标题:Plant Cell:北京师大任海云/中科院生物物理所孙飞合作解析植物细胞微丝的三维结构
肌动蛋白是真核细胞最丰富和保守的蛋白之一,其主要以单体和丝状-微丝两种形式存在,并处于聚合和解聚的动态过程中。通常,微丝是肌动蛋白的主要功能形式,它在囊泡和细胞器运输、胞吞、胞吐以及细胞分裂和生长等许多基本的生理过程中发挥着至关重要的作用。因此,解析微丝的结构对于理解它的功能机制非常重要。近来,伴随着冷冻电子显微镜技术的革新,骨骼肌等多种来源微丝结构得到了解析,但植物细胞微丝结构仍未知。虽然植物和动物细胞肌动蛋白的氨基酸序列保守性很高,但是它们之间的生化特性以及在细胞内的功能并不一样,因此有必要从结构水平上去解释这些功能差异。
近日,The Plant Cell在线发表了北京师范大学生命科学学院任海云教授课题组和中国科学院生物物理研究所孙飞研究员课题组合作完成的题为Cryo-EM Structure of Actin Filaments from Zea mays Pollen的研究论文。该研究使用冷冻电子显微镜技术解析了玉米花粉微丝的高分辨率三维结构,并且通过单分子磁镊方法测定了微丝的稳定性,从结构和单分子力谱实验结果两方面共同证实了玉米花粉微丝的结构比兔骨骼肌微丝更加稳定。

在早期的研究工作中,任海云等成功建立了一套快速而又高效的提纯玉米花粉肌动蛋白的方法,该方法仅需一次亲和层析和一轮肌动蛋白聚合及解聚过程,就能提纯得到高产量和高纯度的肌动蛋白。之后,任海云课题组揭示了玉米花粉和兔骨骼肌肌动蛋白的功能差异。
由于微丝样品本身具有柔性以及不均一性,很难形成三维结晶,因此无法使用传统的X射线晶体衍射法对其结构进行解析。任海云教授和孙飞研究员课题组克服困难,最终使用冷冻电镜螺旋三维重构技术成功解析了3.9 Å玉米花粉微丝的结构(图1)。
玉米花粉微丝是一个类双链的螺旋结构,由链内和链间互作所稳定。虽然整体结构与其它已知结构的真核细胞微丝类似,但是玉米花粉肌动蛋白亚基的DNase I-binding loop (D-loop) 更往外弯曲,这样的构象有利于其与相邻的链内亚基之间形成更多的互作位点。此开放型D-loop构象类似于Jasplakinolide或者氟化铍(BeFx)稳定的兔骨骼肌肌动蛋白亚基。
这一结构特征暗示着,与兔骨骼肌微丝相比较,玉米花粉微丝可能有一个较高稳定性的结构。此外,任海云教授课题组建立了体外直接测定微丝稳定性的单分子磁镊实验体系,对单根玉米花粉和兔骨骼肌微丝的抗拉强度进行了测定,结果显示单根玉米花粉微丝比兔骨骼肌微丝更抗拉力。
该研究结果为解释不同物种来源肌动蛋白的功能差异提供了结构学基础,为解释植物细胞内微丝作为长距离囊泡和细胞器运输的轨道这一现象提供了新的思路。
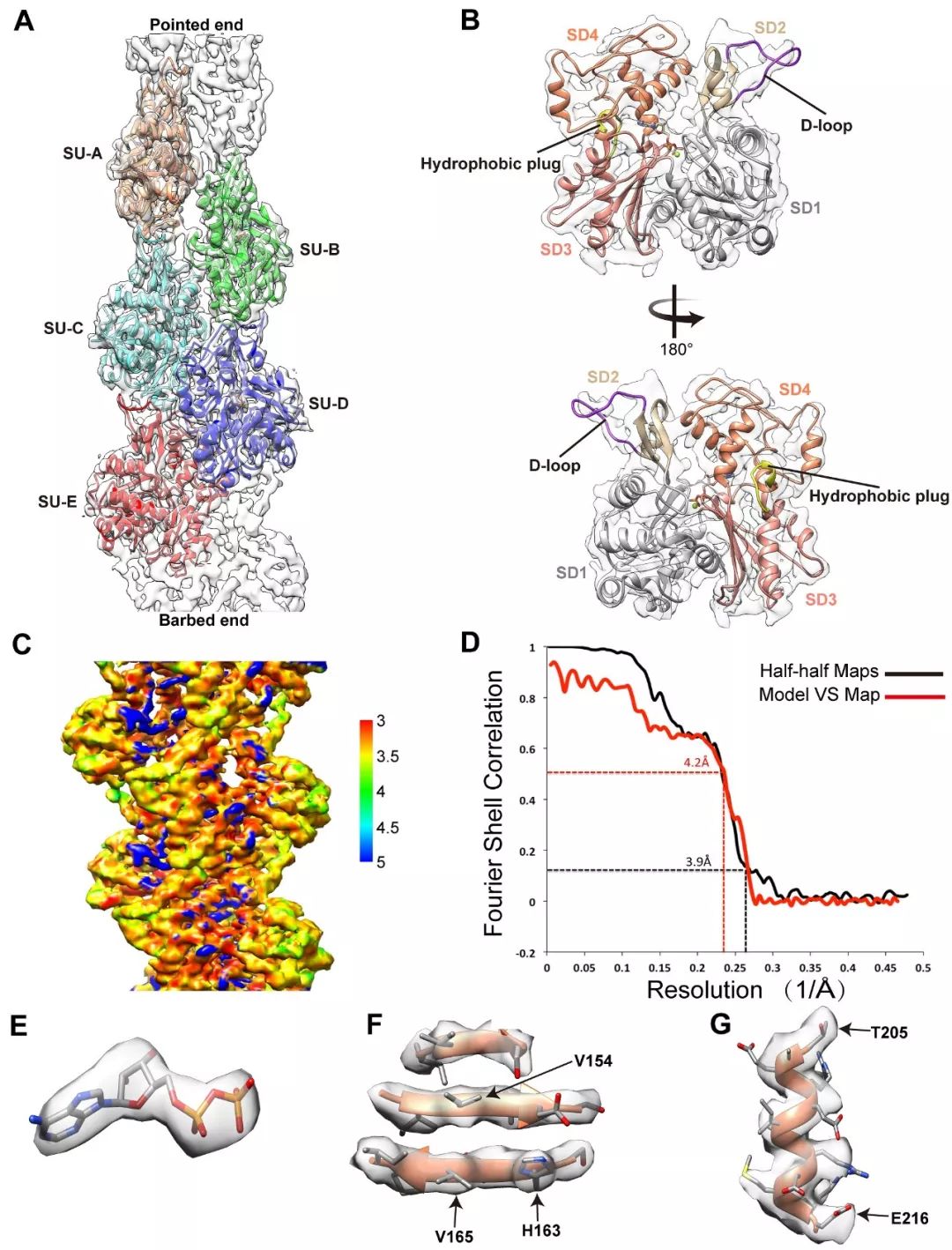
图1 玉米花粉微丝的三维结构
任展宏(任海云组)和张艳(孙飞组)为该研究论文的共同第一作者。任海云教授和孙飞研究员为本研究论文的共通讯作者。该研究得到了国家自然科学基金委和国家重点基础研究发展计划的经费支持、中国科学院生物物理研究所生物成像中心的冷冻电镜技术支持、中国科学院物理研究所李伟老师课题组的单分子磁镊技术支持以及美国弗吉尼亚大学Edward H. Egelman教授在冷冻电镜数据分析方面的支持。
论文链接:
http://www.plantcell.org/content/early/2019/10/18/tpc.18.00973
来源:bioartplants BioArt植物
原文链接:http://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247492720&idx=2&sn=874160b9bda6e8d5f4047aad20b4a8cf&chksm=fd737e17ca04f70135d834b4c0298130d29919201e707fb83686b3da97f534bccc938022d8b8&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Plant Cell | 中国农业大学田丰/李溱揭示玉米驯化过程中的代谢分化
植物细胞悬浮培养
四师农科所三区科特派团队到67团进行科技服务


全面综述植物细胞间迁移的转录因子决定细胞命运
将植物普通细胞变为干细胞的基因找到

中文解读 | 基底膜在血脑屏障发育及维护屏障功能中的作用
关注丨晒粮食引发人命官司,交通部门:又是我的错?
Cell 揭示植物中连接细胞膜和叶绿体的抗病信号途径,详细解读!
植物细胞

Cell 重磅!陆生植物起源标志被揭示:吸收紫外线和细胞壁的合成