科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-24
来源:BioArt植物
“龙生九子,各有不同”,在种类繁多的豆类植物中,这种现象更为明显。从扁豆、红花菜豆到四季豆,它们的种子数量和大小以及荚果的大小都不相同。有趣的是,当你打开豆荚时,会发现每个豆荚里的种子大小一致且间距相同。事实上,这种排列模式也适用于非豆类植物,植物进化出该策略以减少受精后相邻胚珠或种子之间进行的养分竞争,从而保证繁殖成功并将遗传资源转移到下一代【1】。
包裹种子的角果的长度决定了种子数量,并且控制雌蕊(最终发育为角果)伸长的激素信号网络已经被阐明【2】,但是该调控网络并未涉及胚珠发育的规则启动。最近的一项全基因组关联研究鉴定了NERD1(NEW ENHANCER OF ROOT DWARFISM1)作为胚珠数量的正调节因子,但是在胚珠间距调控中没有发挥特定作用【3】。在拟南芥中的研究发现,ERECTA(ER)基因座是决定果实大小和胚珠数量的关键因子,ER编码LRR受体激酶并在气孔发育、脉管结构和叶缘锯齿的模式形成中发挥作用【4】。此外,ER家族受体的配体属于富含半胱氨酸的EPF/EPFL(EPIDERMAL PATTERNING FACTOR/EPF-like )分泌肽家族,可以通过不同受体复合体或ER的相互作用在气孔发育和叶缘锯齿中起调节作用【5】。但是目前尚不清楚ER或EPF/EPFL分泌肽是否参与调控胚珠原基间距的模式形成。
近日,德国杜塞尔多夫大学(Heinrich-Heine University)Rudiger Simon课题组在Current Biology在线发表了题为A Peptide Pair Coordinates Regular Ovule Initiation Patterns with Seed Number and Fruit Size的研究论文,揭示了ER家族受体激酶及EPEL分泌肽协同调节拟南芥种子数目和角果大小的遗传机制。

该研究首先结合自然变异分析和QTL分析,发现ER基因座最可能是影响种子密度(种子间距)的候选基因。进一步的功能分析表明,ER 是控制种子密度所必需的,并且在不同的遗传背景下具有相似作用。ER的两个同源基因ERL1和ERL2在调节植物株型方面具有重叠但截然不同的功能【6】。该研究发现,erl1/2 单突变体没有明显的表型变化但是erl1-2;erl2-1双突变体的果实变短且种子密度降低,这与er 突变体中的果实变短但种子密度增加相反。以上表明,ERL1/ERL2与ER共同调控果实生长,但是两者在种子密度的调节中起拮抗作用。该研究还表明,EPFL9作为与ER家族受体结合的配体,也可以影响果实发育和种子密度。
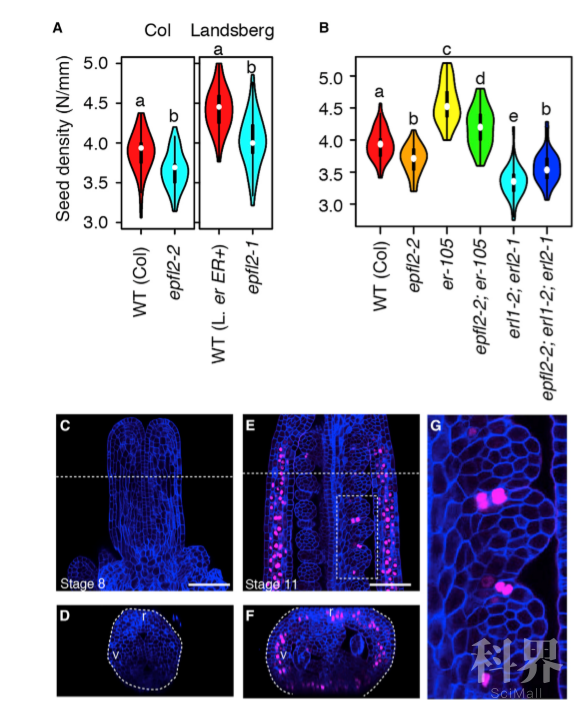
Identification of EPFL2 as a Patterning Regulator of Ovule Initiation
此外,该研究通过QTL分析在候选基因座中鉴定了EPFL2,发现erfl2 的突变导致果实变短且种子密度降低。有趣的是,这种表型在导入ER 基因组序列后并未发生改变。基于erfl2 与erl1-2;erl2-1以及epfl2-2; erl1-2; erl2-1三重突变体的相似表型,该研究表明ERL1和ERL2是感知EPFL2的关键受体。对上述基因的表达模式分析发现,EPFL2在胚珠原基的边界即胚珠间隙表达,而EPFL9 仅在瓣膜的内部细胞层表达以控制果实生长。EPFL2的突变或错误表达会破坏正常的胚珠启动模式并降低种子密度,进一步说明了精确的EPEL2表达在种子密度调控中的作用。该研究还发现,即使存在活性EPFL2 基因的情况下,从EPFL2 启动子表达EPFL9 也会干扰胚珠启动模式,这表明EPFL9原则上可以拮抗EPFL2的功能。最后,该研究还通过体外试验证明了EPFL2对ERL1和ERL2的结合偏好性。

EPFL2 and EPFL9 coordinate gynoecium and fruit growth with ovule initiation
总之,EPFL2是将规则的胚珠间距与果实生长联系起来的决定因素,而EPFL9主要影响果实生长。该研究还表明植物通过EPFL2/ERL1/ERL2和EPFL9/ER信号传导途径共同协调胚珠的排列模式和果实生长。
参考文献
【1】5. Alonso-Blanco, C., Blankestijn-de Vries, H., Hanhart, C.J., and Koornneef, M. (1999). Natural allelic variation at seed size loci in relation to other life history traits of Arabidopsis thaliana. Proc. Natl. Acad. Sci. USA 96, 4710–4717
【2】Cucinotta, M., Di Marzo, M., Guazzotti, A., de Folter, S., Kater, M.M., and Colombo, L. (2020). Gynoecium size and ovule number are interconnected traits that impact seed yield. J. Exp. Bot. 71, 2479–2489
【3】Yuan, J., and Kessler, S.A. (2019). A genome-wide association study reveals a novel regulator of ovule number and fertility in Arabidopsis thaliana. PLoS Genet. 15, e1007934.
【4】Shpak, E.D., McAbee, J.M., Pillitteri, L.J., and Torii, K.U. (2005). Stomatal Patterning and Differentiation by Synergistic Interactions of Receptor Kinases. Science 309, 290–293
【5】Tameshige, T., Okamoto, S., Lee, J.S., Aida, M., Tasaka, M., Torii, K.U., and Uchida, N. (2016). A Secreted Peptide and Its Receptors Shape the Auxin Response Pattern and Leaf Margin Morphogenesis. Curr. Biol. 26, 2478–2485.
【6】Shpak, E.D., Berthiaume, C.T., Hill, E.J., and Torii, K.U. (2004). Synergistic interaction of three ERECTA-family receptor-like kinases controls Arabidopsis organ growth and flower development by promoting cell proliferation. Development 131, 1491–1501.
来源:bioartplants BioArt植物
原文链接:https://mp.weixin.qq.com/s?__biz=MzU3ODY3MDM0NA==&mid=2247498444&idx=1&sn=3cf00890fd00db8b1e6940b25e0d40c3&chksm=fd7360abca04e9bdeb98a71292879ad5534d89730a5d4925f5f1229402634f27f7ca49ff1446#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
华南植物园发现光周期调控植物种子大小的普遍性规律

研究揭示植物种子萌发时间调控机理

植物所在拟南芥种子休眠机制研究中取得进展

植物学领域最新进展集锦 | 木质部形成调控、番茄响应盐胁迫、拟南芥种子寿命
植物所发现乙烯调控种子休眠形成新机制

动物所发现鼠类可通过种子雨同步性调控植物间的合作与对抗
植物所发现拟南芥调控种子休眠和萌发的新成员
海藻糖代谢信号调控拟南芥分枝形成
植物所揭示光调控种子休眠和萌发的分子机理

中国科学家首揭灵长类动物发育和寿命调控的关键通路