科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-09-27
来源:BioArt
炎症小体(Inflammasome)是在免疫监测中发挥关键作用的超分子复合物(Supramolecular complexs)。炎症性caspases的激活可导致白细胞介素1β(IL-1β)的蛋白成熟和焦亡。炎症小体活动异常与许多人类疾病有关,包括遗传性自身炎症综合征和痛风、糖尿病、动脉粥样硬化、阿尔茨海默病和结直肠癌等疾病【1】。NLRP3(Nucleotide-binding domain, leucine-rich repeat, and pyrin domain-containing protein 3)会被细菌毒素尼日利亚菌素、细胞外ATP以及多种微粒比如尿酸钠晶体、明矾、硅颗粒以及淀粉样蛋白等激活,而pyrin炎症小体可以被艰难梭状芽胞杆菌毒素B的Rho-葡糖基化活性激活。炎症小体激活的重要标志是形成单个超分子点状聚集(Supramolecular punctum)或者说斑点(Speck)。但是目前为止斑点的位置以及蛋白运输还的具体机制还不得而知。
近日,美国哈佛医学院吴皓研究组、密歇根大学Yongqing Li研究组以及Venkat Giri Magupalli、Roberto Negro合作在Science发文题为 HDAC6 mediates an aggresome-like mechanism for NLRP3 and pyrin inflammasome activation,揭开了NLRP3与pyrin炎症小体激活过程中炎症小体斑点的具体形成与调控机制。

先前有研究发现在许多炎症小体激活的细胞中,炎症小体被组装存在于单一的核周围斑点【2】。在真核细胞中,中心体也是微管组织中心 (Microtubule-organizing center,MTOC) 其同样也是位于核周围并呈点状。为此,作者们在表达NLRP3以及其他炎症小体组分的细胞系中进行脂多糖、尿酸钠以及尼日利亚菌素的处理,对NLRP3以及NLRP3激活后招募的caspase-1招募蛋白ASC的定位与中心体标记物的定位进行检测(图1)。除了NLRP3以及ASC,IL-1β也会共同定位在炎症小体斑点处。另外,作者们发现caspase-1通过二聚化在炎症小体位点处首次被激活,随后在切割后被释放到胞质之中。因此,NLRP3在微管组织中心处形成的炎症小体可能会作为caspase-1激活以及IL-1转换的主要位点。通过活体细胞成像的实验,作者们进一步确认了NLRP3位于MTOC处的炎症小体会招募pro-caspase-1以及pro-IL-1β进行加工和激活。而且,在一些细胞中作者们发现了炎症小体斑点信号存在一些与微管染色相吻合的信号,说明炎症小体复合物会通过微管网络进行物质运输。
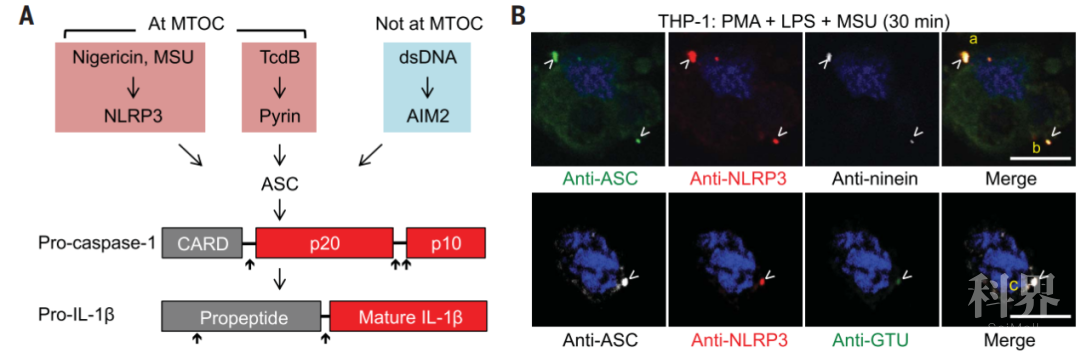
图1 不同刺激促进细胞产生炎症小体与微管组织中心的共同定位情况
由于泛素蛋白酶体途径无法有效降解泛素化蛋白聚集物,清除泛素化蛋白聚集物的一种主要细胞机制需要动力蛋白适配因子和α-微管蛋白去乙酰化酶HDAC6的逆行运输,在MTOC形成聚集体并通过自噬对蛋白聚集物进行降解【3,4】。为此,作者们希望对HDAC6以及微管逆行运输抑制对NLRP3功能的影响进行检测,作者们发现微管动力蛋白机器以及HDAC6适配因子对于NLRP3炎症小体的激活均非常关键,但此过程并不依赖于α-微管蛋白的乙酰化。
既然HDAC6对于NLRP3炎症小体的激活非常关键,作者们想知道究竟是HDAC6蛋白中哪一个结构域在发挥关键作用。为此,作者们构建了Hdac6-/6-的细胞系,并分别用野生型的HDAC6以及去乙酰化酶催化突变体进行回补实验。作者们惊奇地发现NLRP3炎症小体的激活并不依赖于HDAC6的去乙酰化酶活性。先前有研究表明HDAC6的C-端包含一个锌指结构域对于泛素蛋白相互作用非常重要【5】。作者们在泛素结合结构域中引入突变进行回补实验检测后发现,HDAC6的泛素结合结构域对于NLRP3炎症小体具有关键作用。另外,HDAC6功能缺失会抑制NLRP3以及pyrin炎症小体的激活,该抑制作用是非常特异的,对于AIM2、NLRC4以及其他非经典验证小体没有太明显的影响(图2)。

图2 HDAC6特异性地影响定位与MTOC处的炎症小体中caspase的激活
进一步地,作者们希望对HDAC6在体内的功能进行鉴定。为此,作者建立了一个脂多糖诱导的内毒素休克小鼠模型。在该模型中,Hdac6-/-与野生型小鼠相比,IL-1β等分泌明显降低,说明HDAC6在体内对于NLRP3炎症小体的激活也是非常重要的。随后,作者们对另外一个NLRP3的直接激活模型检测,使用NLRP3刺激物尿酸钠对小鼠进行处理,在体内诱发腹膜炎。通过白介素分泌、中性粒细胞的数目等数据再次证明了HDAC6在NLRP3炎症小体激活中的关键作用。
总的来说,该工作发现NLRP3以及pyrin炎症小体会在中心体也就是微管组织中心处进行组装,作为capase-1以及IL-1β的主要激活位点发挥作用。而动力蛋白适配因子组蛋白去乙酰化酶HDAC6对于该类型的炎症小体的组装和激活在体内和体外均证明具有关键性作用。而且,HDAC6中起到关键调节作用的并非HDAC6的去乙酰化酶活性而是其泛素结合结构域。因此,该工作揭开了一条特异性调节NLRP3与pyrin炎症小体的信号通路。
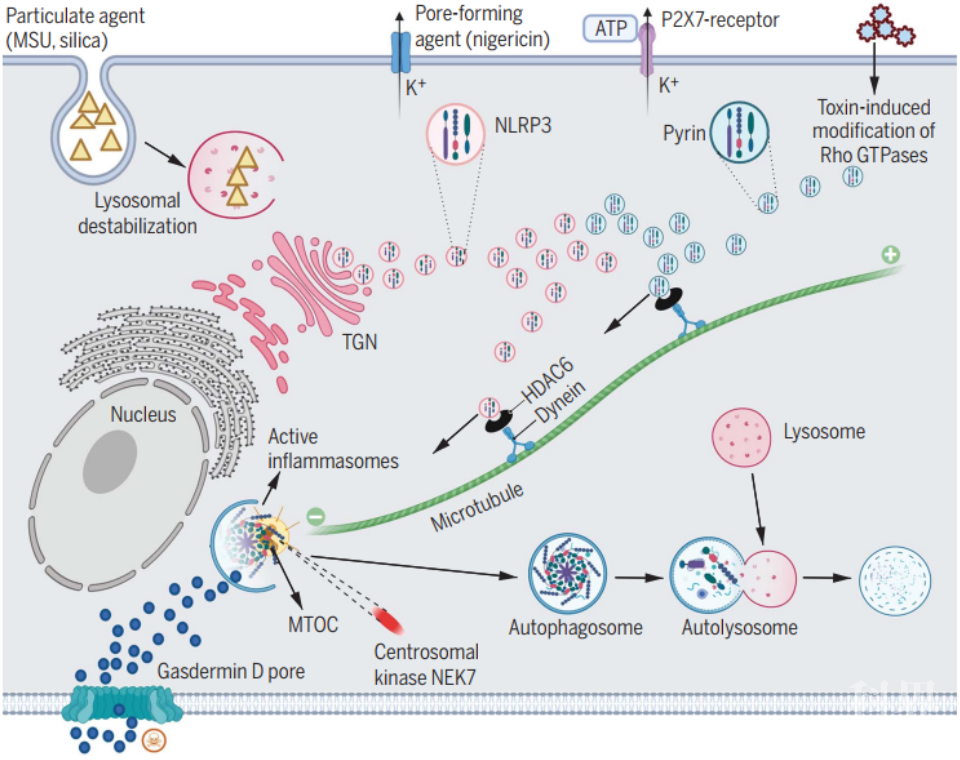
图3 工作模型
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652501188&idx=1&sn=57be4bd2dcd5bbb1ed592fcb85c9f695&chksm=84e26770b395ee6666b82eaa51e071751811b13512d0a22bda8d64b32003863eb07474b2bb01#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

昆明动物所等发现褪黑素通过抑制NLRP3炎症小体激活拮抗吗啡镇痛耐受
研究发现褪黑素通过抑制NLRP3炎症小体激活拮抗吗啡镇痛耐受
吃辣到底会不会长痘?
中国科大等发现NLRP3炎症小体特异性抑制剂

植物特异性非编码RNA功能分析
曹雪涛《NatRevImmunol》发表综述阐述抗感染固有免疫反应的表观遗传调控
新研究:揭示泛素化修饰异常的NLRP3炎症小体导致早发性炎症性肠病的新机制
胰腺特异性抗原(PaA)

今日科技话题:“天狗咬日”、茶多酚可促进糖尿病伤口愈合、宇宙中锂丰度最高恒星、岛屿生活让鸟脑更大、高级别生物安全实验室投用

靳津/李异媛揭示炎症信号通路底物特异性的识别机制