科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-25
来源:BioArt
动物几乎都需要睡眠。在人和果蝇中,睡眠均有一种常规的结构,即夜间睡眠时间较长,白天睡眠则表现为片段化【1】。所谓睡眠片段化(sleep fragmentation),是睡眠过程中的反复的短暂的觉醒,改变了正常的睡眠结构,从而影响睡眠质量。睡眠结构和睡眠总量对于大脑的功能都至关重要,而睡眠片段化自身也能导致哺乳动物和果蝇的认知缺陷以及其他生理问题【2,3】。因此,研究睡眠结构有助于人类深入了解大脑功能,改善睡眠问题。
2019年10月24日,布兰迪斯大学的Leslie C. Griffith团队的刘畅博士(论文共同通讯,目前为中国科学院深圳先进技术研究院研究员)等在Current Biology以长文形式发表了题为A serotonin-modulated circuit controls sleep architecture toregulate cognitive function independent of total sleep in Drosophila的文章,阐述了果蝇5-羟色胺信号作用于椭球体的神经环路调节睡眠结构,且睡眠片段化影响认知功能,并发现了两类椭球体(ellipsoid body)神经元,形成5-羟色胺介导的调控睡眠结构的神经环路中心。

5-羟色胺(5-phydroxytryptamine, 5HT)是人类睡眠的调节因子之一。增强5-羟色胺信号通路的药物被广泛应用于治疗包括情绪异常等多种疾病,而服用这些药物的很多患者表现出睡眠结构异常。脊椎动物中的研究表明5-羟色胺的功能十分复杂,既能诱导和维持睡眠,又能促进觉醒【4】。果蝇,因其遗传操作便利、中枢神经小巧,分子机制保守等特性,作为研究睡眠的模型已经超过二十年【5】。以往的研究人员通过分析果蝇的色氨酸羟化酶(一种限速合成酶)突变体和5HT1a、5HT2b受体突变体发现5-羟色胺能促进睡眠【6,7】。
而在此文中,刘畅等则利用果蝇对5-羟色胺在睡眠中的作用进行了探索,通过热激活或者光激活5-羟色胺神经元,并对果蝇进行睡眠行为分析,发现果蝇睡眠片段的数量显著增加(图1 C-D),睡眠片段的长度(长片段可代表深度睡眠状态)显著变小,即激活5-羟色胺神经元能导致睡眠片段化。与对照组果蝇相比,热激活5-羟色胺神经元后对睡眠的总量却没有影响(图1 E)。当停止激活5-羟色胺神经元后,果蝇表现出“补觉”的现象(图1 F),说明睡眠质量自身也可影响睡眠稳态的调控。因此,刘畅等研究人员认为5-羟色胺神经元能在不影响睡眠总量的情况下调节睡眠结构。
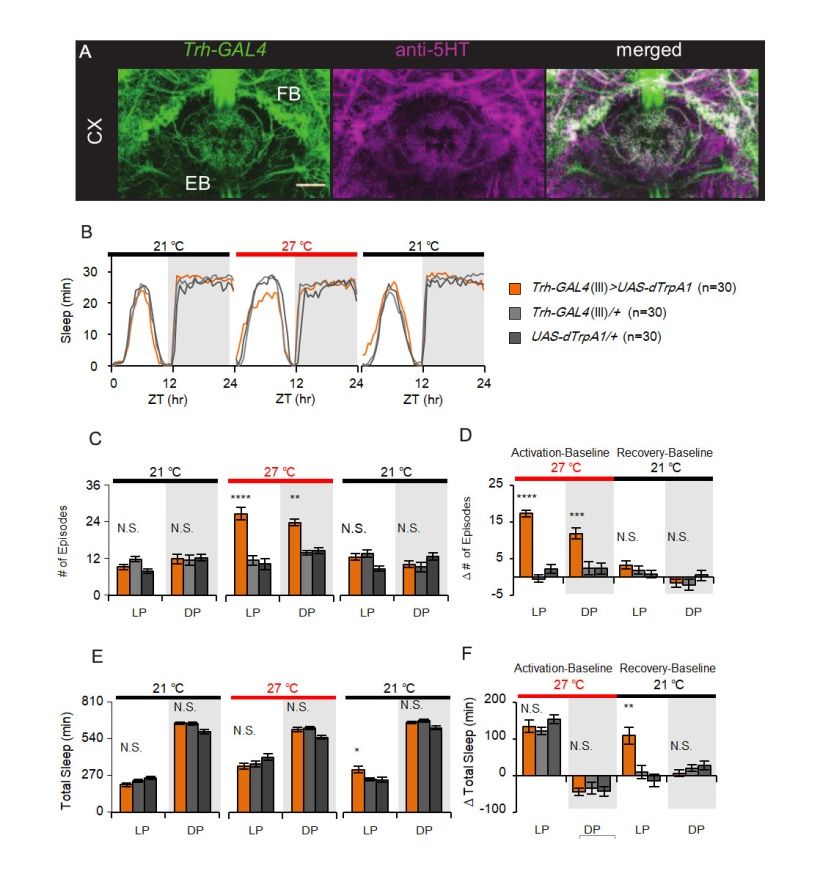
图1. 激活5-羟色胺神经元之后导致果蝇睡眠结构片段化。A: Trh-GAL4标记的5-羟色胺神经元投射到中央复合体CX(包括椭球体EB和扇形体FB); B:5-羟色胺神经元激活前、激活过程中以及激活后的睡眠时间变化; C-D:激活5-羟色胺神经元,睡眠片段显著增多; E-F:激活5-羟色胺神经元睡眠总量没有明显变化,当停止激活5-羟色胺神经元后即在睡眠恢复阶段,睡眠时间增加。(图片整合于论文Liu et al.,2019)
为细致了解5-羟色胺神经元对睡眠结构的影响,刘畅等研究者人员在此研究过程中采用了两种新方法进行分析,一种是通过分析果蝇一天内的睡眠片段持续时间与觉醒次数的关系,并利用睡眠片段累积分布曲线图直观地显示睡眠结构的特征。长睡眠片段,大多数只存在于夜间睡眠,在行为学上表示深度睡眠的状态【8】。200min的睡眠片段长度是睡眠分布的中位数,刘畅等研究人员选此作为“长睡眠片段”的临界值,研究发现,热激活5-羟色胺神经元,果蝇在白天和夜晚的长睡眠片段的比例显著减少。这个结论可通过观测实验组果蝇群体的睡眠片段累积分布曲线向左平移来表示(图2A)。
另外一种新方法,即分析睡眠和觉醒两种状态间相互转换的可能性:P(wake)和P(doze)值。P(wake)表示果蝇从睡眠状态到觉醒状态的可能性,代表着觉醒驱动力,在野生型果蝇中,P(wake)是总睡眠时间的主要决定因素,多巴胺信号增强时,P(wake)的值增加【1】。P(doze)则表示从觉醒状态到睡眠状态的可能性,可表示睡眠驱动动力。通过分析,刘畅等研究人员发现:在5-羟色胺神经元被激活时,P(doze)明显增加,导致觉醒向睡眠的转换增多,但是P(wake)则没有明显变化(图2 B-C)。当5-羟色胺神经元从激活中释放,即果蝇处于睡眠恢复阶段时,P(wake)显著下降即从睡眠向觉醒的转换可能性降低(图2B),这和果蝇“补觉”行为有关, 这也意味着P(wake)的降低是对于睡眠片段化的一种稳态响应。
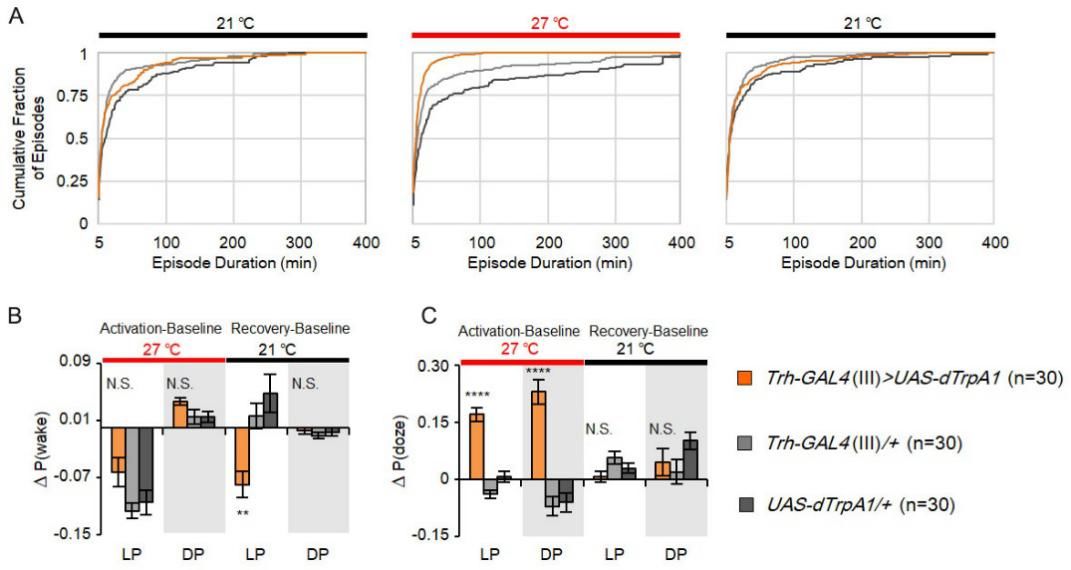
图2.激活5-羟色胺神经元之后导致果蝇睡眠片段时长以及睡眠-觉醒状态的转换可能性发生改变。 A:当5-羟色胺神经元处于激活状态时睡眠片段积累分布曲线向左平移;B:5-羟色胺神经元被激活时,果蝇P(wake)无明显变化,5-羟色胺神经元从激活中释放之后,果蝇P(wake)显著降低;C:5-羟色胺神经元被激活时,果蝇P(doze)显著增加;5-羟色胺神经元从激活中释放之后,果蝇P(doze)无明显变化。(图片整合于论文Liu et al.,2019)
同时,为进一步理解睡眠片段化是否影响学习能力,刘畅等研究人员利用气味-厌恶性刺激(电击)联合学习记忆范式衡量果蝇的学习能力,发现当激活5-羟色胺神经元24小时造成睡眠片段化之后,果蝇表现出明显的厌恶性气味学习能力下降。此外,通过药理学和遗传学手段证明了果蝇学习能力的降低不是5-羟色胺自身对学习的影响,而是由于睡眠片段化造成。
进一步的研究发现5-羟色胺神经元投射在果蝇的扇形体(FB)和椭球体(ellipsoid body,EB)区域。椭球体,是果蝇中央大脑最主要的结构,以往的研究表明该结构能调节感觉、整合运动协调【9】。前期解剖学发现,根据轴突末端分支特征和投射方式,椭球体神经元可分为R1,R2, R3, R4m和R4d 五种类型【10】。椭球体中表达几种5-羟色胺受体,其中包括5HT7。
刘畅等发现椭球体中有两类不同的神经元参与调节睡眠结构但不影响睡眠总量:即5-HT7受体神经元和R2神经元。5-HT7受体被认为和哺乳动物的快速眼动睡眠(REM)有关。5-HT7受体神经元投射在椭球体R2, R3 和 R4d,包含约 100个细胞(图3B),能感应并直接应答于5-羟色胺信号。刘畅等研究人员通过检测5-HT7受体突变体的睡眠,发现其在白天和黑夜均表现出更为稳固的睡眠;当给野生型果蝇喂食5HT7受体拮抗剂,睡眠也变得更加稳固,只有夜间睡眠总量发生些微改变。因此,研究人员揭示了5HT7受体调节睡眠的方式和其他已发现的5-羟色胺受体如5-HT1a 、5-HT2b等作用不同(5-HT1a促进睡眠,5-HT2b调控睡眠稳态)。并且发现激活5-HT7受体神经元后,与激活5-羟色胺神经元类似,不影响睡眠总量,但睡眠片段的数量约增加了4倍。当神经元从激活中释放后,果蝇会进行“补觉”。R2神经元,包括16-18个细胞(图3A),激活R2神经元之后同样不影响睡眠总量,显著增强白天睡眠片段的数量,但是当该神经元从激活中释放后,则没有补觉现象。刘畅等研究人员发现这两类神经元虽然在结构上不同(图3C),功能却类似。通过结合遗传学,药理学和离体功能成像技术等发现:两类神经元之间存在着具有相互作用的突触连接,激活R2神经元可抑制5-HT7受体神经元的活性(图3D),两种神经元很可能形成一个相互作用的环路来调节睡眠结构。
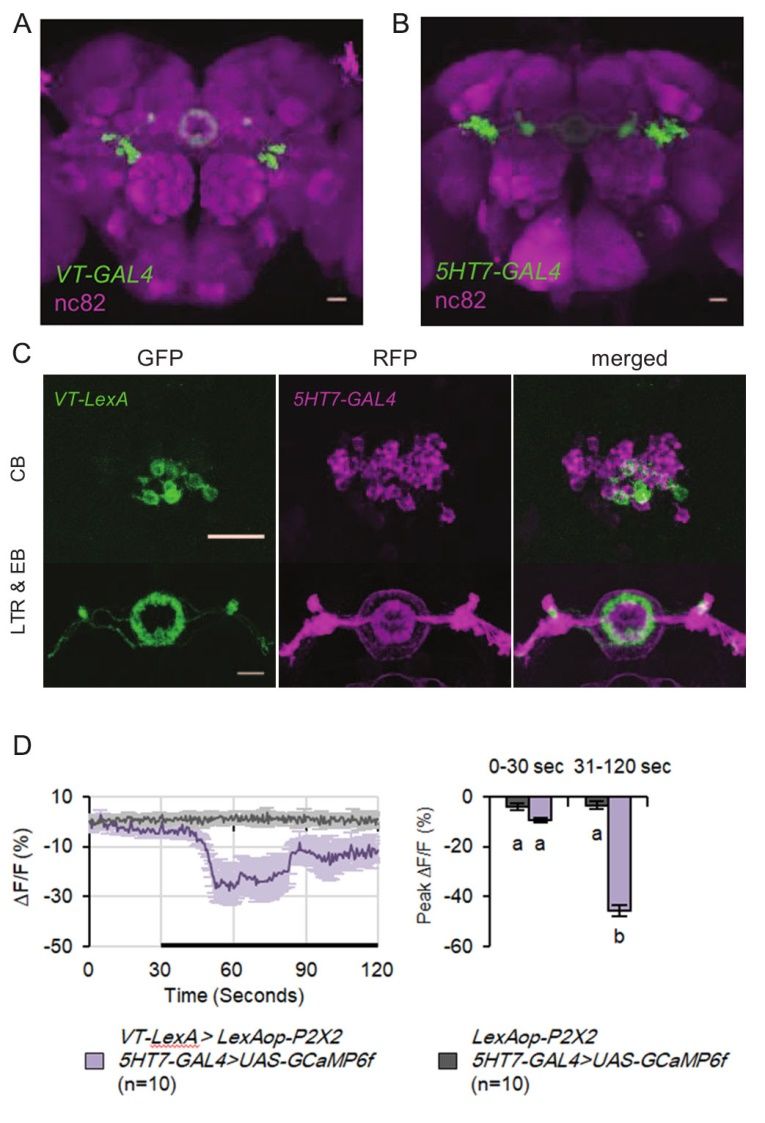
图3. 参与睡眠结构的调控椭球体中两类神经元(R2和5-HT7受体神经元)存在相互作用的突触连接。A:VT-GAL4+神经元在椭球体中的投射区域; B:5-HT7 GAL4+神经元在椭球体中的投射区域; C:VT-LexA+和5-HT7GAL4+神经元胞体投射区域小部分重合; D:VT-LexA+神经元抑制5-HT7 GAL4+神经元。(图片整合于论文Liu et al.2019)
最后,刘畅等研究人员采用trans-Tango技术(可以鉴定接收特定神经元的突触输入信号的技术),探索5-HT7受体神经元和R2神经元的下游脑区或者神经元,发现:在椭球体内,R2 神经元和超过50%的5-HT7受体神经元具有突触连接;在椭球体外,则与扇形体(FB)和原脑桥(protocerebral bridge,PB)细胞具有功能联系,但是R2神经元自己内部间的联系较少,与中央复合体外的连接几乎为零。不同的是,5-HT7受体神经元大概有60%的内部细胞之间具有较强的功能联系,并且和几乎所有的R2神经元具有功能联系,也与中央复合体中的扇形体细胞,原脑桥细胞,以及中央复合体外的蘑菇体细胞具有功能连接。
刘畅等研究人员的这项研究不但揭示了5-羟色胺能调控果蝇的睡眠结构,激活5-羟色胺神经元能导致睡眠的片段化,并造成其学习障碍,并且发现5-羟色胺的下游作用靶点5-HT7受体神经元和R2神经元也有相似的功能,并且两种神经元存在相互作用,很可能形成一个调控睡眠的局部环路。
该研究的共同通讯作者刘畅研究员和Leslie C. Griffith教授表示:这项研究揭示了5-羟色胺对睡眠的影响,在果蝇中,5-羟色胺能在不影响睡眠总量的情况下,控制调节睡眠和觉醒的中央复合体环路。据我们所知,这是首次发现的果蝇中调节睡眠结构而同时不影响睡眠总量的神经环路。
原文链接:
https://doi.org/10.1016/j.cub.2019.08.079
参考文献
1. Wiggin, T. D. et al. State-Switching Probability Reveals Sleep-RelatedBiological Drives in <em>Drosophila</em>. bioRxiv, 263301, doi:10.1101/263301(2019).
2. Stepanski,E. J. The effect of sleep fragmentation on daytime function. Sleep 25, 268-276, doi:10.1093/sleep/25.3.268 (2002).
3. VanSomeren, E. J. & Cirelli, C. Disrupted Sleep: From Molecules toCognition. 35, 13889-13895, doi:10.1523/jneurosci.2592-15.2015 (2015).
4. Monti,J. M. Serotonin control of sleep-wake behavior. Sleep medicine reviews 15,269-281, doi:10.1016/j.smrv.2010.11.003 (2011).
5. Shaw,P. J., Cirelli, C., Greenspan, R. J. & Tononi, G. Correlates of sleep andwaking in Drosophila melanogaster. Science(New York, N.Y.) 287, 1834-1837,doi:10.1126/science.287.5459.1834 (2000).
6. Yuan,Q., Joiner, W. J. & Sehgal, A. A sleep-promoting role for the Drosophilaserotonin receptor 1A. Current biology :CB 16, 1051-1062,doi:10.1016/j.cub.2006.04.032 (2006).
7. Qian,Y. et al. Sleep homeostasis regulatedby 5HT2b receptor in a small subset of neurons in the dorsal fan-shaped body ofdrosophila. 6, doi:10.7554/eLife.26519 (2017).
8. vanAlphen, B., Yap, M. H., Kirszenblat, L., Kottler, B. & van Swinderen, B. Adynamic deep sleep stage in Drosophila. TheJournal of neuroscience : the official journal of the Society for Neuroscience33, 6917-6927,doi:10.1523/jneurosci.0061-13.2013 (2013).
9. Strausfeld,N. J. & Hirth, F. Deep homology of arthropod central complex and vertebratebasal ganglia. Science 340, 157-161,doi:10.1126/science.1231828 (2013).
10. Martin-Pena,A. et al. Cell types and coincidentsynapses in the ellipsoid body of Drosophila. The European journal of neuroscience 39, 1586-1601, doi:10.1111/ejn.12537 (2014).
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652476978&idx=4&sn=0daaace5216db31dc2fd714e055520ad&chksm=84e20586b3958c90554256d85b9fe431c552e66d5bc926743e104bcded25497c5b4a8a281b1c&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

《Cell》神经元诱导干细胞重生

金纳米粒子保护神经元免于细胞死亡
脑损伤激活胶质细胞产生神经元研究获进展
Ucp2依赖的小胶质细胞-神经元耦合调控焦虑样行为
衰老: 恢复雄性果蝇的性欲
脑损伤激活胶质细胞产生神经元研究获进展
揭秘癌细胞与神经元的“共生共舞”
陈荣清/彭碧文/王云/朱沛旻 共同主持专刊 | 非神经元细胞对神经元的调节

人类皮肤细胞直接“变身”运动神经元

脑损伤激活胶质细胞产生神经元研究获进展