科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-03
来源:BioArt
DNA的甲基化失调与肿瘤的发生发展密切相关,越来越多的研究表明DNA甲基化可作为肿瘤治疗的新靶标。DNA羟甲基化酶TET可以通过一系列的迭代氧化反应最终实现5位甲基胞嘧啶(5mC)的去甲基化过程,在基因组表观遗传调控中扮演重要角色。TET家族包含TET1,TET2,TET3三个成员,其中TET2的突变经常发生在髓系造血系统恶性肿瘤中,特别是急性髓系白血病。在实体瘤中TET2虽然很少发生突变且表达量与正常组织相比也没有明显改变,但是基因组的5位羟甲基胞嘧啶(5hmC)在肿瘤细胞中显著降低,表明TET的活性在肿瘤中被抑制。北卡罗来纳大学教堂山分校的熊跃教授团队近期的一项研究表明,TET2通过介导的IFN-γ/JAK2/STAT1信号通路,促进细胞趋化因子CXCL9、CXCL10、CXCL11的表达,从而促进T淋巴细胞浸润和肿瘤免疫。维生素C作为TET的辅因子,可刺激TET2活性并增加趋化因子表达和淋巴细胞浸润,从而增强抗肿瘤免疫和PD-L1抗体的治疗效果,首次发现了维生素C可以作为肿瘤免疫治疗的辅助药物(Xu et al. Journal of Clinal Investigation. 2019)。这一成果被今年发表在Science translational medicine(Magrì et al,2020) 和PNAS(Luchtel et al,2020)上的两篇研究论文证实。
受这项工作的启发,熊跃教授团队研究人员开始寻找提高肿瘤细胞TET活性的方法。TET活性除了受到辅因子α-酮戊二酸,维他命C的调控外,蛋白翻译后修饰例如乙酰化,磷酸化都被发现参与TET活性的调控。熊跃教授团队此前的研究发现TET蛋白可以被单泛素化修饰来促进TET与底物DNA的结合能力从而增强其活性 (Nakagawa et al. Molecular Cell 2015)。单泛素化修饰通常是可逆的并且可以被相应的去泛素化酶(DUB)移除。那么,TET蛋白是否有对应的DUB介导其去泛素化过程从而负调控TET的活性?
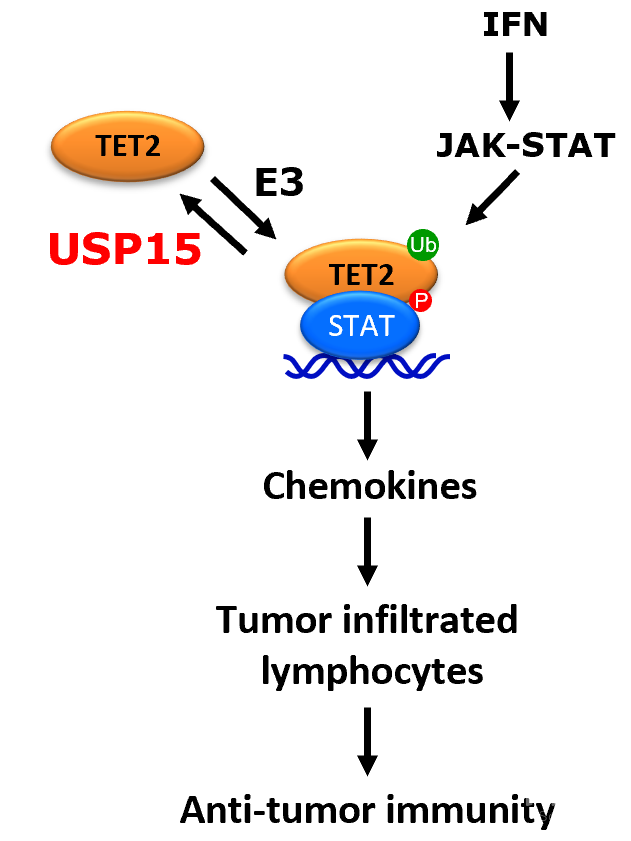
近日,同济大学生命科学与技术学院的徐艳萍教授和北卡教堂山分校熊跃教授团队在Science Advances上发表文章USP15 suppresses tumor immunity via deubiquitylation and inactivation of TET2,发现去泛素化酶USP15可以负调控TET2活性,从而抑制肿瘤免疫。

USP15可以催化TET2 赖氨酸1299位的去单泛素化,从而抑制TET2与其底物DNA的结合,下调TET2的活性,抑制细胞趋化因子CXCL9、CXCL10、CXCL11的表达。研究人员随后通过对USP15敲除以及TET2敲除的黑色素瘤细胞的转录组进行分析,发现USP15与TET2对许多免疫信号通路的基因有着相反的调控作用,表明USP15是TET2的一个重要调控因子。黑色素瘤细胞中USP15的缺失会促进趋化因子的表达以及肿瘤内T细胞的浸润,从而增强免疫治疗效果,显著抑制肿瘤生长,并且这个促进作用依赖于TET2蛋白。
总的来说,该研究团队发现了一个此前未知的TET2的调控蛋白USP15, 并证明其负调控TET2活性以及抑制肿瘤免疫。该研究为增强实体瘤如黑色素瘤的免疫疗效提供了一个新的可能的靶点。在以后的研究中如果能发现有效的USP15的抑制剂,将有可能有效的促进肿瘤细胞表达趋化因子,提高肿瘤内淋巴细胞的浸润,从而增强实体瘤的免疫治疗效果。
据悉,北卡罗莱纳大学教堂山分校的博士后陈磊蕾为本文的第一作者,同济大学生命科学与技术学院的徐艳萍教授,北卡罗莱纳大学教堂山分校的熊跃教授为共同通讯作者。
来源:BioGossip BioArt
原文链接:https://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652501873&idx=4&sn=6638d4867473d41297746a537aa051d8&chksm=84e264c5b395edd3ab2ac8d80171a282f8fb2d431b46591308c01a7bfd45a7829a07577ba127#rd
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
研究揭示去泛素化酶USP33调控线粒体自噬新机制
Molecular Plant 出版“植物激素”专辑
研究揭示叶绿体蛋白泛素化介导的光合作用调控新机制
【科技前沿】高璞组揭示病原菌介导的新型泛素化及去泛素化的催化调控机制
Science | 关乎血管生成,去泛素化酶USP10调控Notch信号通路

从代谢和泛素化看肿瘤发生发展
谢旗研究组发现ABA共受体新的泛素化调控模式

生物物理所揭示病原菌介导的新型泛素化及去泛素化的催化调控机制
中国抗癌协会肿瘤介入学专业委员会换届会议召开



谢旗研究组发现ABA共受体新的泛素化调控模式