科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-04
来源:X一MOL资讯
随着肿瘤治疗研究的深入,针对肿瘤细胞具体细胞器的治疗方案也逐渐增多。近日,华侨大学生物材料与组织工程研究所陈爱政教授课题组构建了一种硫化铜纳米颗粒原位生长于层状双金属氢氧化物纳米片上的纳米复合体,能够同时利用H2O2和O2,将它们分别转化为羟基自由基和单线态氧,并破坏溶酶体,在体外及动物水平显示出高效的抗肿瘤效果。
基于活性氧物质(ROS)的肿瘤治疗越来越受关注,然而肿瘤内ROS的生成效率仍然有待提高。该研究成功在层状双金属氢氧化物纳米片(LDH)上原位生长硫化铜纳米颗粒(CuS),构建出一种可生物降解的层状双金属氢氧化物-硫化铜纳米复合材料(LDH-CuS-NCs)。制备的LDH-CuS-NCs在近红外光激发下,吸收光转化为热能,温度的升高促使铜离子溢出,通过类芬顿反应催化H2O2生成羟基自由基;另一方面由于CuS和LDH构成的异质结构,近红外光照射下CuS的电子沿LDH的金属传递,空穴更有效地催化O2转化为单线态氧,从而充分利用肿瘤细胞内的ROS产生源,提高光/化动力治疗效果(如图1所示)。
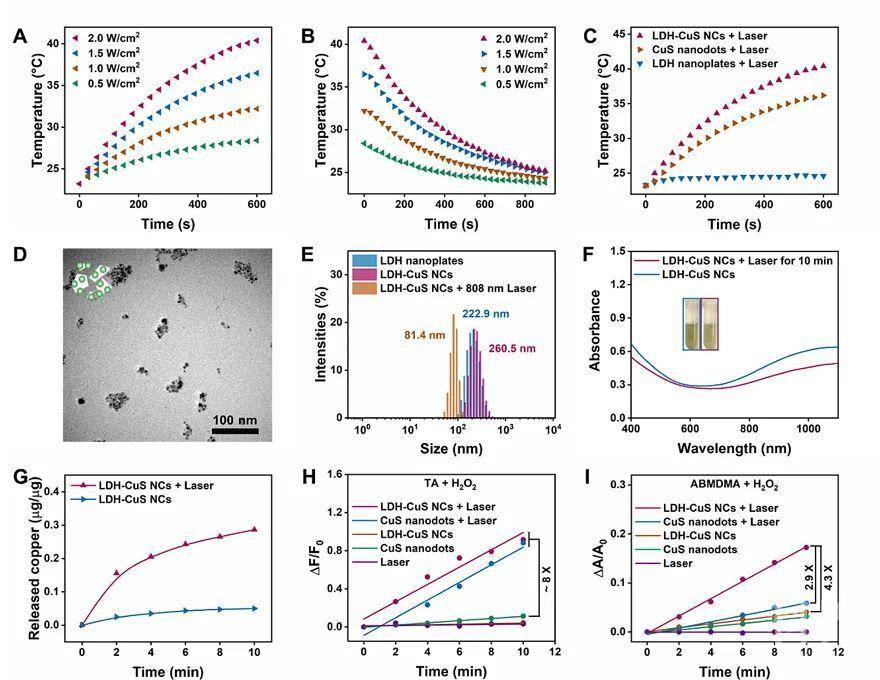
图1. LDH-CuS NCs的近红外光响应性能。不同功率下LDH-CuS NCs的光热(A)升温和(B)降温曲线。(C) LDH-CuS NCs, CuS和LDH的光热升温曲线。LDH-CuS NCs光热后的(D)透射电镜图片,(E)粒径变化以及(F, G)紫外吸收和铜离子溢出。(H, I)生成ROS情况。
同时,相较于正常细胞,肿瘤细胞中溶酶体过度发达,具体表现为溶酶体数量更多,体积更大。LDH-CuS NCs能利用这一特性,其被内吞入细胞并滞留于溶酶体内,在近红外光激发后,ROS产生于溶酶体内,并与溶酶体膜反应发生溶酶体膜脂质过氧化,导致溶酶体膜通透性改变,溶酶体内组织蛋白酶释放至细胞质,加剧肿瘤细胞的死亡(如图2所示)。
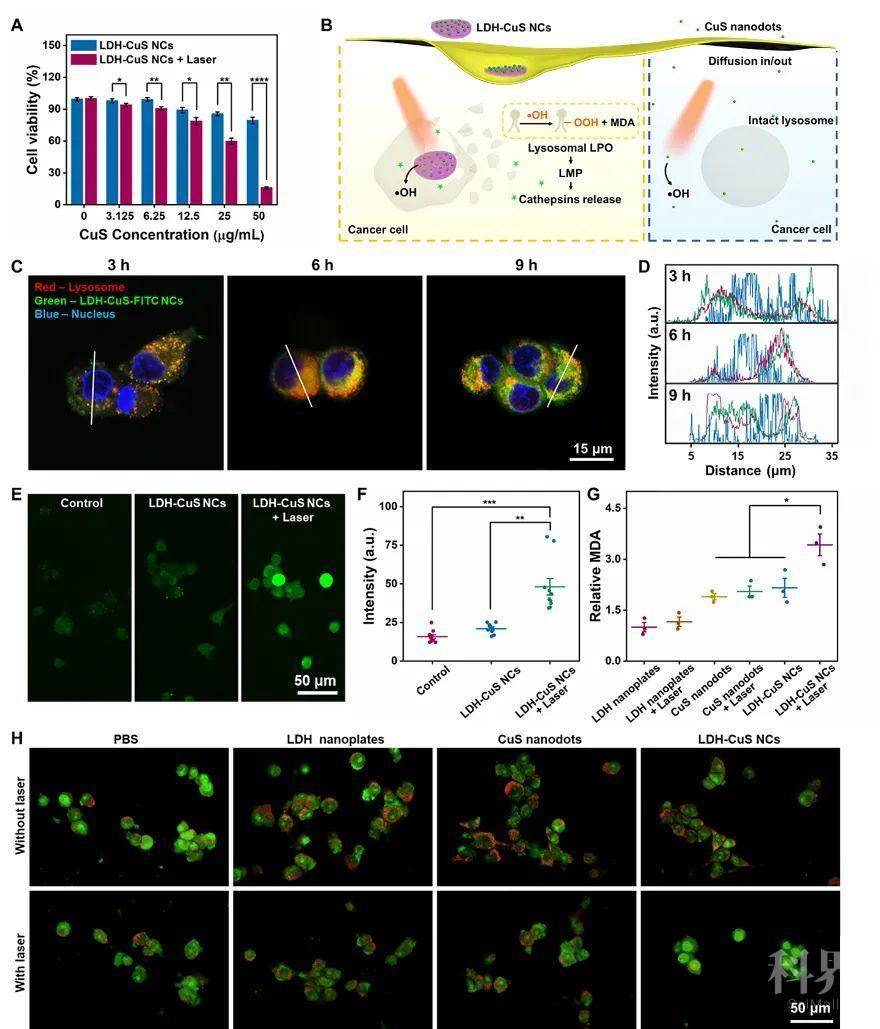
图2. (A)LDH-CuS NCs的体外抑瘤。(B)LDH-CuS NCs和CuS的细胞作用示意图。(C, D)LDH-CuS NCs的细胞定位。(E, F)细胞ROS生成情况。(G)脂质过氧化情况。(H)溶酶体完整性考察。
这一成果近期发表于ACS Applied Materials & Interfaces,华侨大学化学工程与技术专业博士研究生刘晨光为该文章的第一作者,导师陈爱政教授为通讯作者。研究工作由华侨大学陈爱政教授课题组、厦门大学刘刚教授课题组和福建医科大学杨达云副教授课题组共同完成。研究工作得到国家自然科学基金(81971734,U1605225和31800794)及福建省生物材料科技创新团队项目的资助。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657662698&idx=3&sn=9e8010b3672702aa10fffd117b7e43e1&chksm=80f89f3ab78f162c0b3307f4ab5e1ae5dd3385cd2638aa509a4f0b4f68600d3e5cd77e721541&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
MoS4-LDH材料有望成为一种高效吸附剂

学术造假必遭严惩,为何仍不断有人冒险

“促癌黑手”Ter细胞首次发现
《细胞》发文!阿片类药物迎来重大突破
粒细胞与红细胞比值

纳米材料LDH介导的重组质粒叶面喷雾表达amiRNAs,以防治植物DNA病毒侵染

基于LDH/MoS2异质结构浓度调控光催化CO2还原制备不同比例的合成气

LDH(+)-Bir(-)杂化催化剂用于工业条件下长时间高效水氧化
日本用iPS细胞制成角膜细胞

V的引入构建CoFeV-LDH中金属之间奇妙的“共存关系”促进电化学全水分解