科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-26
来源:X一MOL资讯
原标题:郭子建、何卫江团队Angew. Chem.:“光激活”溶酶体逃逸的铂配合物抗肿瘤新策略
药物的选择性激活是智能化抗肿瘤药物设计的重要手段。南京大学化学化工学院配位化学国家重点实验室郭子建、何卫江研究团队最近报道了一种新型的“光活化”铂类抗肿瘤配合物,可在光照下实现溶酶体逃逸从而有效实现核DNA损伤,达到抗肿瘤的目的。利用光照的精确控制,可避免对正常细胞中药物的激活毒性,同时提升肿瘤胞内铂配合物的稳定性,从而增强对癌细胞的杀伤。
顺铂(cisplatin)是一种临床常见的金属抗肿瘤药物,自1978年被美国FDA批准用于临床癌症治疗,在睾丸癌、卵巢癌、头颈癌、肺癌、淋巴瘤和膀胱癌等的治疗中显示了较好疗效,成为最为成功的抗肿瘤化疗药物之一。一般认为顺铂在细胞内经水解后与核DNA结合而阻止DNA复制,从而杀死肿瘤细胞。然而,顺铂对细胞的“无差别攻击”对癌症病人产生了很大的毒副作用。如何降低铂类药物的毒副作用成为抗肿瘤药物研究的重要方向之一。
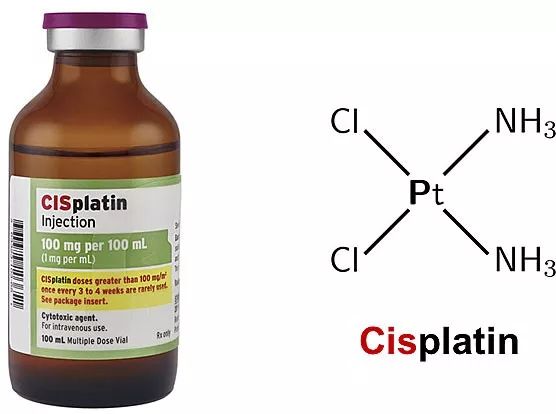
图1. 顺铂注射液及其结构式
铂类药物抗肿瘤的主要作用靶点是核DNA,因此任何影响铂与DNA结合的因素都会导致铂药的失活或肿瘤的耐药,如铂配合物被溶酶体吞噬酸解、被谷胱甘肽结合等最终均导致金属铂泵出胞外而失活。采用生物大分子药物类似的“溶酶体逃逸 (lysosomal escape)”机制,南京大学化学化工学院配位化学国家重点实验室郭子建、何卫江研究团队发展了一种具有“光活化”溶酶体逃逸功能的光敏性铂配合物,有利于克服上述失活机制(Pt-BDPA,图2),并有望利用光照的精确控制特点实现对实体肿瘤的选择性损伤。设计的这种简单的铂类小分子配合物Pt-BDPA是一种较弱的光敏剂。它通过能量依赖的吞噬方式进入细胞并被限制在溶酶体中。因未能与核DNA的结合,化合物对肿瘤细胞和正常细胞均显示很弱的暗毒性,为“溶酶体限制状态”。对细胞进行光照刺激时,Pt-BDPA诱导产生活性氧(ROS)破坏溶酶体,从而释放铂配合物,实现化合物的“溶酶体逃逸”,进而与核DNA结合而对细胞产生明显的毒性。同时研究发现光诱导ROS还导致胞内GSH含量因氧化和降低,有效提高了铂药进入细胞核与DNA结合的浓度,最终大大提高了铂配合物的抗肿瘤活性。
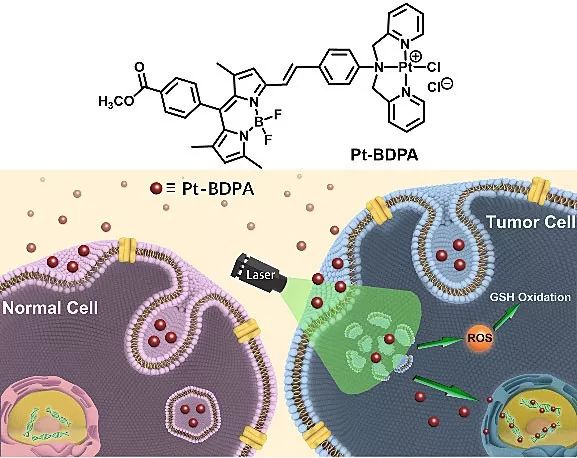
图2. 具有“光激活”溶酶体逃逸机制的Pt-BDPA对正常细胞和肿瘤细胞的作用示意图
通过对MCF-7, A549及HeLa等多个细胞系的MTT研究表明,在无光照条件下Pt-BDPA的IC50明显大于50 μM,而进行短时间光照则其IC50值仅为3-6 μM。同时化合物对多种正常细胞的暗毒性也较低(IC50明显大于50 μM)。研究还表明这种光照后导致的细胞损伤主要源于铂配合物的化学损伤,而非光诱导ROS导致的损伤。该研究对于推动下一代铂类药物的设计具有重要的科学意义和应用价值,也为克服化疗药物副作用的研究开辟了新途径。进一步发展近红外光光激活溶酶体逃逸铂配合物将有利于获得适用于临床应用的新型铂药体系,将为铂类药物的临床抗肿瘤拓展应用提供新的基础。
该工作发表在Angew. Chem. Int. Ed.,通讯作者为南京大学何卫江教授、郭子建院士和南京师范大学化学与材料科学研究院刘红科教授。第一作者是南京师范大学化学与材料科学学院博士后薛旭玲博士。同时,中国药科大学药学院钱程根博士也参与该文章的研究工作。
该研究得到了国家自然科学基金重点项目、面上项目和青年项目等资助,同时特别感谢南京大学配位化学重点实验室、南京大学公共仪器中心以及南京师范大学提供的研究平台支持。
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657621559&idx=7&sn=3cb10df6b037dc82b76c44147c235b1a&chksm=80f83fe7b78fb6f17e48b7e8bec4c08f24134932069331b86e7f632b78fc6282a55587bb71f8&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn