科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-26
来源:brainnews
紫红质通道蛋白(channelrhodopsins ,ChRs)是在能进行光合作用的藻类中发现的光门控离子通道蛋白。在大脑中转基因表达ChRs使得靠光就能激活神经元。这些通道蛋白在神经科学研究中被广泛应用。然而,现有ChRs的局限性阻碍了许多光遗传的应用。
例如,ChRs在可见光区有较宽的激活光谱并且需要较高强度的光激活(~1mW mm-2)。由于ChRs是天然的低导通道,需要在神经元的质膜中表达105-106个功能性ChRs,才能介导足够的光依赖性去极化和诱导神经元激活;在老鼠脑中,激活ChRs需要距目标细胞群100μm以内发射1-15 mW光以确保引起动作电位,这限制了光依赖激活脑组织的体积(~1 mm3)。在不需要植入侵入性光纤进行光传输的情况下,发明高光敏感度和高光电流的光遗传离子通道蛋白以激活更大容量的脑组织迫在眉睫。
2019年10月14日,加州理工学院Viviana Gradinarua和Frances H. Arnold实验室在Nature Methods杂志上发表了题为Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics的论文。文章运用了机器学习的方法,即利用大量的ChR变异体文献,为设计高性能的ChRs训练统计模型。
在有限的102个有功能特性的ChRs实验组训练高斯过程模型,设计了高光敏度和高光电流的ChRs。其中三个突变体,即ChRger1-3,在无光纤植入的情况下,光诱导即可使神经元兴奋,也就是说,这种光敏感通道蛋白使经颅光遗传学成为可能。
光遗传学研究离不开病毒,病毒可将表达光敏感通道蛋白的DNA传送到神经细胞中,大部分实验依赖于侵入性的颅内病毒传递,而通过尾静脉注射病毒进而特异感染神经细胞起到传递目的基因的方法在传统光遗传学中应用甚少,因为全身性注射病毒,神经细胞感染病毒量较少,表达ChR2的量不足以介导光依赖性去极化产生动作电位。
ChRger1-3高光敏度和高光电流,少量表达就足以介导光依赖性的动作电位。以下实验结果便是作者使用全身性传递特异感染神经系统的病毒(病毒外壳蛋白是rAAV-PHP.eB)的方式验证ChRger1-3的特性。
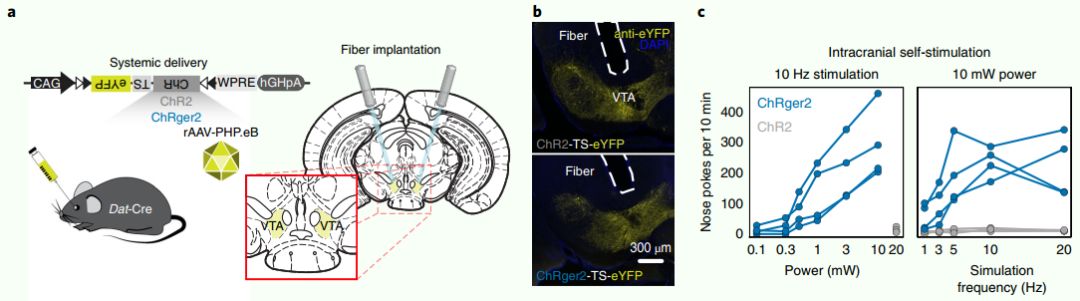
作者使用了光遗传学颅内自刺激腹侧被盖区(VTA)多巴胺能神经元的行为学范式来评估ChRger2的光遗传效率。作者将rAAV-PHP.eB包装的双flox包含ChRger2或ChR2 (H134R)的倒开放阅读框的病毒全身注射到Dat-Cre老鼠(图a和b)。
3周后立体定位植入光纤套管到腹侧被盖区上方,把老鼠放在一个自刺激操作盒,条件性诱导使它们通过鼻子触发447nm激光。表达ChRger2的动物以频率依赖和激光功率依赖的方式表现出强健的光遗传自我刺激。激光频率越高(高达20hz)和功率越高(高达10mw)则促进更大的操作响应率(图c)。相反,激光刺激不能增强表达ChR2(H134R)的动物的操作反应(图c)。
这些结果与急性切片的结果一致,在急性切片中,ChR2(H134R)的光诱导电流较弱,由于其全身性注射病毒,ChR2低拷贝数不足以介导光依赖性去极化产生动作电位。
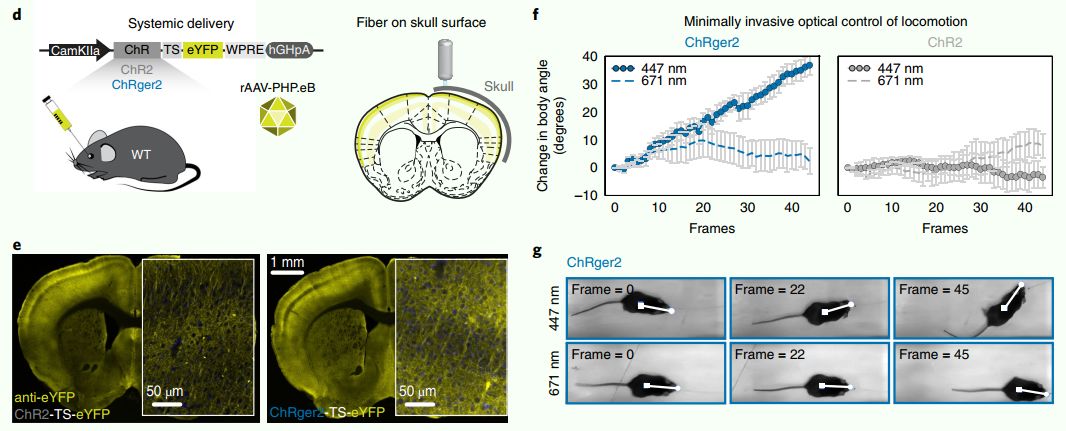
为了确定ChRger2是否能够同时实现微创转基因传递和微创光激发,作者用rAAV-PHP.eB 包装CaMKIIa启动子驱动转录的ChRger2或ChR2(H134R)病毒全身性感染小鼠,检测皮质兴奋性锥体神经元的转基因表达(图d),接着通过对感染病毒老鼠的右侧第二运动皮层(M2)进行无创性光刺激来测试自由运动的动物的运动定向控制。
在实验中,M2单侧刺激可以破坏了对侧下肢的运动功能,导致小鼠偏离刺激侧。尽管颅盖骨的存在引起光散射,用20mW447nm的光刺激可使表达ChRger2的动物发生左转行为,但表达ChR2(H134R)的动物在接受光刺激时则没有发生左转行为(图f)。并且停止光刺激时,发生左转行为的老鼠停止左转。即便光强度低至10 mW,小鼠的光刺激诱导左转行为仍会发生。
为了确保小鼠的转向行为不是由于视觉刺激或激光引起的热刺激所致,作者使用671nm的光源重复了实验,671nm在两个光敏感蛋白的激发光谱之外。20mw671nm的光不能诱导表达ChRger2和ChR2(H124R)的老鼠转向(图g)。总的来说,这些实验表明,ChRger2可用于全身性基因传递,能够实现微创的光遗传兴奋。
参考文献:
Machine learning-guided channelrhodopsin engineering enables minimally invasive optogenetics.
作者信息
编译作者:济沧海(brainnews创作团队)
来源:brainnews brainnews
原文链接:http://mp.weixin.qq.com/s?__biz=MzI2ODEyOTE3OQ==&mid=2649569169&idx=1&sn=ef8726a1528f459dc230eb7e1faeb7fb&chksm=f2edd165c59a58730584d507c890e2de8dd0c602a3f1fa0d8ebfce0f63f436c18312c4bd7ccf&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn
遗传学:局部环境影响基因表达
遗传学:狗狗社交性的潜在遗传基础

基因变异让秘鲁人矮小,或有利于高原生活
光遗传学: 用光对哺乳动物骨骼肌的首次刺激
遗传学:寻找男性性取向的遗传联系
Nature:表观遗传学进展将遗传学、环境与疾病联系了起来!
遗传学与表观遗传学前沿暨第三届中国青年遗传学家论坛会议纪要



遗传学: 杀手是怎样炼成的
遗传学:来自花蟹的基因
光遗传学 & 化学遗传学——打开神经调控的开关