科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-10-31
来源:BioArt
KRAS原癌蛋白是一种GTP激酶,介导细胞内与肿瘤细胞生长和存活相关的信号通路。在正常细胞中,KRAS通过水解GTP成GDP而完成从激活型的GTP结合状态转变为GDP结合的失活状态。KRAS结合GTP会促进KRAS与效应蛋白结合从而促进RAF-MEK-ERK(MAPK)信号转导。KRAS的激活突变是多种肿瘤的标志。激活突变会促进KRAS与效应蛋白结合,增加KRAS信号转导【1】。
尽管临床已经批准多种MAPK信号通路抑制剂如MEK、BRAF、EGFR抑制剂治疗一些类型的肿瘤,但是尚未有靶向突变KRAS的药物用来治疗肿瘤在临床获准。还有几种抑制剂因为缺乏临床治疗效果而被禁止用于KRAS突变的肿瘤。利用非选择性作用于肿瘤或者突变的MAPK抑制剂会同时抑制正常细胞中的MAPK信号转导,导致药物副作用较大,这也限制了抑制剂与其他方法联合治疗。
2019年10月31日,美国加利福尼亚州安进公司(Amgen Inc)的 J. Russell Lipford和Jude Canon 联合在Nature上发表了题为“The clinical KRAS(G12C) inhibitor AMG 510 drivesanti-tumour immunity”。作者优化了一系列的抑制剂,以增强其选择性和有效性。他们发现了KRAS(G12C)的第一个抑制剂AMG 510。AMG 510单独使用或者联合免疫检查点抑制剂都能够促进肿瘤对肿瘤免疫治疗的敏感性。作者在文章里也展示了AMG 510具有前景的临床治疗效率。

KRAS(G12C)突变位点存在于13%的肺腺癌,3%的结肠癌和2%的其他实体瘤。KRAS(G12C)的突变的半胱氨酸与失活状态的KRAS的口袋P2相邻。因为这个缘故,许多研究致力于开发共价抑制剂,最终ARS-1620问世, 第一个针对突变KRAS的抑制剂。作者鉴定了一系列利用KRAS(G12C) 中未开发的表面凹槽开发出的丙烯酰胺类的新型抑制剂。大量的筛选和基于结构的设计,开发出了第一个能够到达人临床试验的抑制剂AMG 510 (clinicaltrials.gov identifier NCT03600883)。
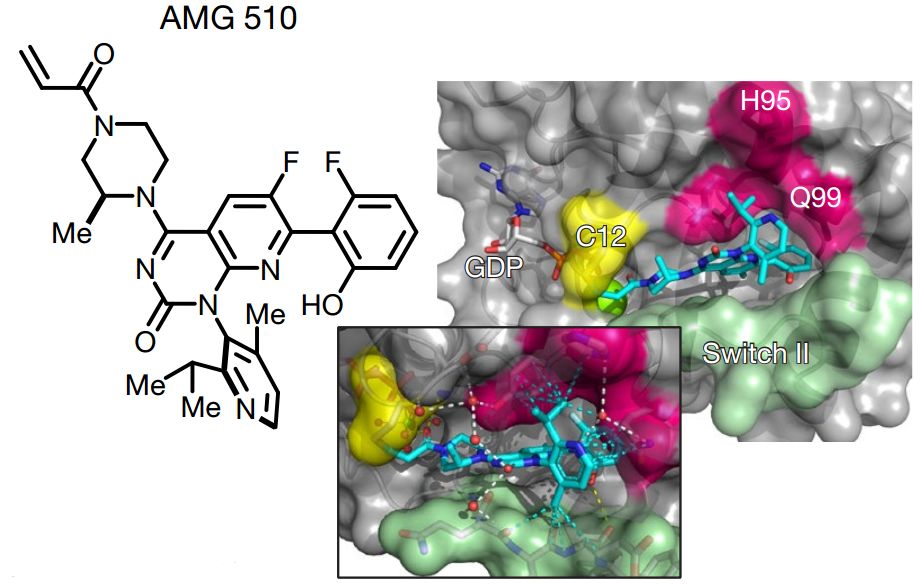
KRAS(G12C)表面有一个凹槽是由His95的转向构成的。这个凹槽能够被芳香烃占据,促进与KRAS(G12C)蛋白的结合。AMG 510是与His95凹槽结合的首选的候选分子。X射线晶体结构分析也显示了AMG 510-KRAS(G12C) 共价结合复合物。进一步分析发现AMG 510不会抑制不存在KRAS(G12C) 突变的细胞系中的ERK的激活。AMG 510能够破坏所有存在KRAS(G12C)突变的生长,除了细胞系SW1573。利用细胞系和PDX行体内实验发现,在有T细胞的小鼠体内做实验,并给与AMG 510处理,能够达到治愈;然而在不含T细胞的小鼠体内则只能达到抑制肿瘤的作用。而且AMG 510不会抑制KRAS(G12V) 突变的细胞系的体内生长。这些表明免疫系统是促进AMG 510治愈肿瘤的关键。AMG 510进行临床试验时行口服,每天一次。四个非小细胞肺癌的病人在给予AMG 510 (180 mg, n = 3; 360 mg, n = 1) ,能够维持病人42周和29周,其中两例病人经过6周治疗后,肿瘤分别缩小了34%和67%。利用AMG 510和化疗药物卡铂联合处理含有KRAS(G12C) 肺腺癌的小鼠能够促进治疗效果。
联合AMG 510和免疫检查点抑制剂治疗CT-26KRASG12C模型发现,单独使用其中一种治疗方法能够抑制小鼠的肿瘤生长,联合两种方法则能够治愈小鼠的肿瘤。经过进一步的分析发现AMG 510能够促进肿瘤中免疫细胞特别是CD8+T细胞的浸润。并且检测发现浸润的免疫细胞高表达CXCL10和CXCL11趋化因子,这两种趋化因子能够促进T细胞和树突状细胞的浸润【2】。在体外将骨髓来源的树突状细胞和CD8+T细胞共培养发现AMG 510不会阻碍T细胞反应并且促进MHCⅠ分子表达,然而MEK的抑制剂则会破坏有效的T细胞反应。这些都表明AMG 510联合免疫检查点抑制剂治疗KRAS(G12C)的肿瘤能够有效建立抗肿瘤T细胞效应。
本文充分展示了即使肿瘤中KRAS(G12C )表达存在高度异质性时,AMG 510仍然能够发挥有效的抗肿瘤作用。
原文链接:
https://doi.org/10.1038/s41586-019-1694-1
参考文献
1. Simanshu DK,Nissley DV, McCormick F. RAS Proteins and Their Regulators in Human Disease. Cell 2017; 170(1): 17-33; doi 10.1016/j.cell.2017.06.009.
2. Gao Q, Wang S, Chen X, Cheng S, Zhang Z, Li F et al. Cancer-cell-secreted CXCL11promoted CD8(+) T cells infiltration through docetaxel-induced-release of HMGB1in NSCLC. Journal for immunotherapy ofcancer 2019; 7(1): 42; doi10.1186/s40425-019-0511-6.
来源:BioGossip BioArt
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MzQyNjY1MQ==&mid=2652477184&idx=2&sn=5ca19d31a3499f115da0c36abe2397eb&chksm=84e204b4b3958da2cfdab61bf8354ddfd8b39404eda0006729a7343b8f4a4846bae601c8359e&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

Science Advances│王红霞团队研究揭示乳腺癌循环肿瘤细胞异质性

【学术前沿】贝锦新/曾益新/张泽民联合解析鼻咽癌异质性和肿瘤微环境复杂网络

中科院等科学家合作研究揭示胰腺癌肿瘤-微环境高度异质性细胞特征

【科技前沿】王红阳/陈磊/高栋通过单细胞测序技术揭示肝胆肿瘤异质性

Cancer Cell :王心伟团队揭示肝癌肿瘤异质性驱动肿瘤微环境重编程的影响

单细胞测序主题月活动第三期|单细胞组学研究肿瘤异质性和转移
第六届全国药物毒理学年会在重庆成功举办




Cell: 肿瘤内的异质性才是决定肿瘤免疫反应的关键

2020 CCO | 主旨报告-雷群英:代谢异质性—肿瘤发生发展的幕后之手

纯干货:给肿瘤绘制家谱,单细胞测序在肿瘤异质性和发育研究中的大显神通!