科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-10-27
来源:X一MOL资讯
根据世界卫生组织统计,癌症已经是世界第二大致死因素。化疗作为治疗癌症的主要手段,但由于缺乏肿瘤选择性,存在较大的毒副作用等问题。前药和药物递送系统是提升抗癌药物的选择性和降低毒副作用的两个有效策略。前药是活性药物的非活性前体,在人体内进行酶代谢从而活化,改善母体药物的药代动力学特征。药物递送系统可以将化疗药物靶向递送到肿瘤部位,提高治疗效果和控制药物释放。分子印迹聚合物(MIP)已经被广泛应用于药物递送,但MIP和前药的联合使用,此前未见文献报道。
近日,南京大学刘震课题组报道了基于MIP的智能前药递送系统。该系统以分子印迹纳米颗粒为载体,具有特异性靶向肿瘤细胞,长时间肿瘤部位保留,以及肿瘤微环境触发释放药物的特点。不同于传统的前药需要依赖肝脏的生物转化,该分子印迹前药递送体系是肿瘤依赖性的,而非肝脏依赖性的,避免了肝脏部位酶的影响。该工作为发展智能前药递送纳米载体开辟了新的路径。
对于MIP的合成,作者利用课题组自主研发的先进印迹方法——硼亲和定向可控表面印迹法(Angew. Chem. Int. Ed., 2015, 54, 10211-10215; Nat. Protocol., 2017, 12, 964–987),将目标前药5-脱氧-5-氟胞苷(DFCR)(卡培他滨的一级代谢产物)和癌症靶标唾液酸(SA)共印迹到纳米粒子上,形成双模板分子印迹聚合物(dt-MIP);当携带了DFCR的dt-MIP到达肿瘤部位时,该纳米载体能通过与SA结合而靶向识别癌细胞,同时长时间保留在肿瘤部位;在该条件下,DFCR缓慢从该载体中释放出来,被癌细胞摄取,经过两部酶转化(胞苷脱氨酶,胸苷磷酸化酶),生成活性分子5-氟尿嘧啶(FU),诱导癌细胞死亡(原理见图1)。
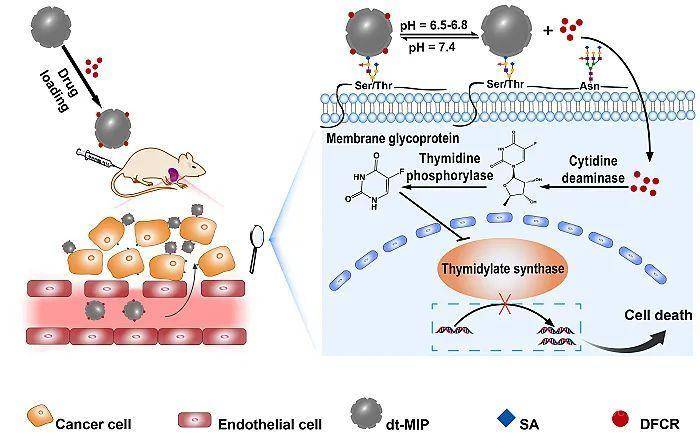
图1. 双模板分子印迹聚合物载药递送原理图
作者通过共聚焦荧光和流式细胞术,证明了dt-MIP对于癌细胞的靶向能力(图2)。紧接着,作者证实了载药dt-MIP可以被pH = 6.8的酸性微环境触发,可控释放药物(pH = 7.4时不释放)。同时,载药dt-MIP与HepG-2共孵育48 h后,细胞抑制率为58%,证实了载药dt-MIP的细胞毒性(图3)。同时,作者考察了不同材料在荷瘤裸鼠体内的分布,相比于非靶向的纳米粒子,dt-MIP可以在肿瘤部位保留更长的时间(10天)(图4)。最后,作者考察了载药dt-MIP的抑瘤效果,相比起空白对照组(PBS)和裸药对照组(DFCR),载药dt-MIP具有最佳的肿瘤抑制效果(图5)。
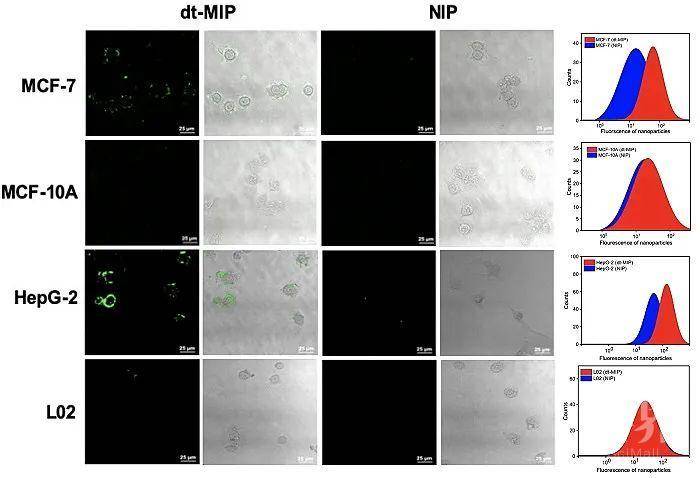
图2. dt-MIP对于过表达SA的癌细胞系和不表达SA的正常细胞系特异性靶向实验结果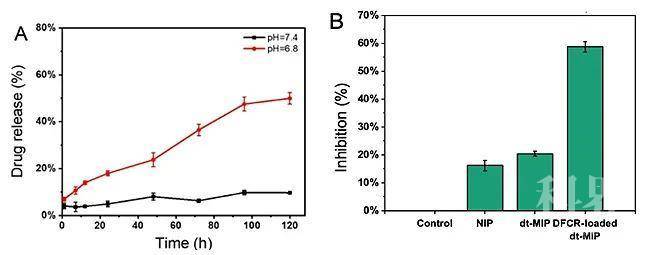
图3. A) 不同pH 条件下的药物释放曲线;B) 细胞抑制率实验结果
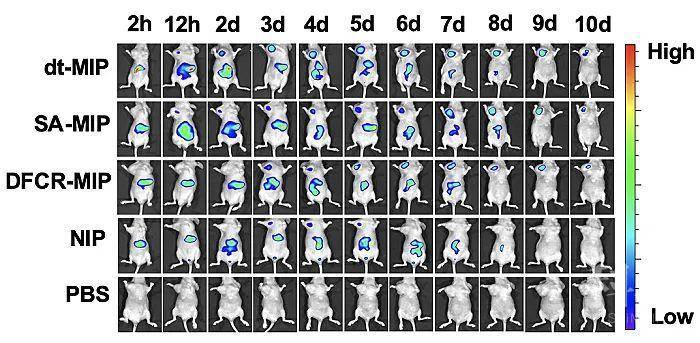
图4. 注射不同材料的荷瘤裸鼠的体内荧光分布
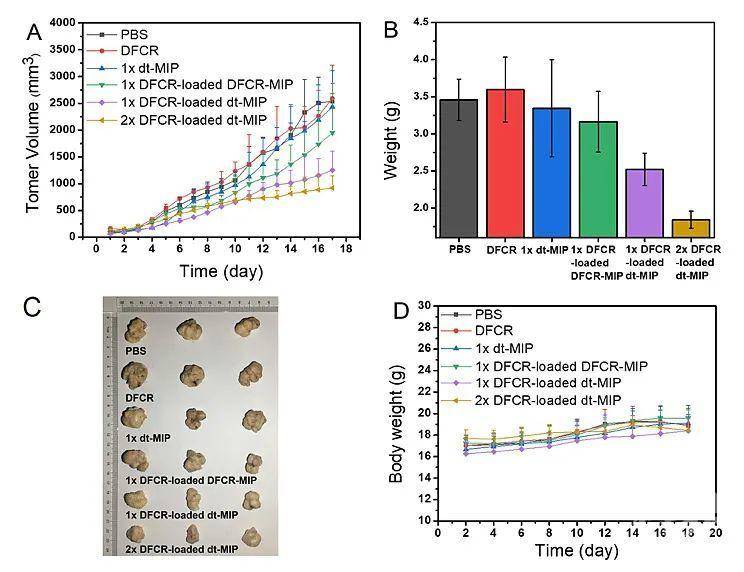
图5. 荷瘤裸鼠抑瘤实验结果
总结
作者通过结合前药和分子印迹技术,发展了一种分子印迹聚合物前药递送体系,该体系具有特异性靶向肿瘤组织,长时间的肿瘤保留能力以及肿瘤微环境触发药物释放的优势;同时,该体系是肿瘤依赖性的而非肝脏依赖性的。这种性质使前药的选择更加具有灵活性,另外,已有多个先进的印迹方法可使的MIP的制备更加便捷和高效,分子印迹技术在智能前药递送方面具有巨大的潜力。
该成果近期发表在Angew. Chem. Int. Ed. 上,文章的第一作者为南京大学博士研究生顾自宽和硕士董月茹(已毕业),南京大学许舒欣博士和加拿大渥太华大学医学院Lisheng Wang教授为共同作者。该工作得到国家自然科学基金重点项目(21834003)、国家重点研发计划(2018YFC0910301)和南京大学卓越计划(ZYJH004)等的经费支持。
刘震教授课题组在分子印迹技术用于抗肿瘤方面已连续取得重要进展(Chem. Comm., 2017, 53, 6716-6719; Angew. Chem. Int. Ed., 2019, 58, 10621-10625)。最近,课题组综述了近年来MIP在抗肿瘤方面的最新进展(Angew. Chem. Int. Ed., 2020,DOI: 10.1002/anie.202005309)。
原文:
Molecularly imprinted polymer‐based smart prodrug delivery system for specific targeting, prolonged retention and tumor microenvironment‐triggered release
Zikuan Gu, Yueru Dong, Shuxin Xu, Lisheng Wang, Zhen Liu
Angew. Chem. Int. Ed., 2020, DOI: 10.1002/anie.202012956
来源:X-molNews X一MOL资讯
原文链接:http://mp.weixin.qq.com/s?__biz=MzAwOTExNzg4Nw==&mid=2657665709&idx=7&sn=74485251bff9a400be81f0891586cc24&chksm=80f8eb7db78f626b1ab40887febd8f3c2da4c1ab0d8069d9a3648b3c923453f30f22a094785d&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

肿瘤标志物升高,就是癌症?
纳米探针让肿瘤组织现形

【癌症知多少】肿瘤标志物为什么可以提示肿瘤?
烟台海岸带所在绿色分子印迹技术应用方面获进展

绿色分子印迹技术研究中取得新进展
新疆理化所研发二维分子印迹固相萃取技术纯化石榴皮单宁

【癌症知多少】什么是肿瘤?
用于癌症治疗的智能纳米药物
第22届全国肿瘤防治宣传周启动仪式在北京举行




国家纳米中心肿瘤纳米疫苗构建研究获进展