科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-04

昨天(11月3日)有媒体报道说,中国科学院上海药物研究所传出的信息表明,由中国海洋大学、中科院上海药物研究所、上海绿谷制药有限公司研发的一款治疗阿尔茨海默症的新药已通过国家药品监督管理局批准,其可用于轻度至中度阿尔茨海默症,改善患者认知功能。报道称,该药将为患者提供新的治疗方案。
消息甫出,立刻成为舆论热议焦点。这倒不是因为这款新药如报道所说的“全球首次上市”因此给阿尔茨海默症患者带来福音,而是因为此药的共同研发单位之一——上海绿谷制药有限公司的“抗癌产品”“绿谷灵芝宝粉剂”的广告曾被当时的国家食品药品监督管理局判定为“严重欺骗和误导消费者”。国家食品药品监督管理局在2008年发布的通知里点名“绿谷灵芝宝粉剂”等6种“违法情节严重,违法发布频次高”的保健食品广告,指出“绿谷灵芝宝粉剂”是将保健功能的产品“冒充药品”,“声称对疾病具有治疗作用”。
正是11年前的这纸通知,让阿尔茨海默症新药陷入舆论漩涡。当然,这其中也不乏对上海绿谷制药有限公司的公允之论:“逻辑上我们要注意,10几年前是个骗子,现在不一定还是骗子,可能洗心革面了。所以具体这个阿尔茨海默症创新药是不是真的有效,还是要看临床试验的结果。”
文章还称,根据这款新药的研制单位“2019年在中国医药创新和投资大会上发布的III期临床试验数据”,其在一个被广泛使用的认知能力测试指标“ADAS-Cog”上的确取得了“统计显著”,因此而“被认为是有效改善患者认知功能”,“但在最关键的24周到36周,对照组的情况出现了谜之恶化”,“所以这个实验在很多医药行业的人看来,有点一言难尽的味道”。“而且除了这个ADAS-Cog的指标外,另一个常用的指标‘CIBIC评分’没有看到统计具有差异的变化。这显然不符合‘多个指标相互验证’的最基本要求”,这可能也是“药监局目前给这个药物授予了‘有条件批准’,要求批准后继续研究机理和长期安全性”的原因之一。
上个月,一家名为Biogen的药企宣布研发出了第一款减缓阿尔茨海默症病状的药物,准备将其作为“突破性药物”提交到FDA(美国食品药品监督局)进行审批,这个审批过程一般需要1至2年。对此新药,舆论并未表现出更多兴奋状。因为目前对阿尔茨海默症的基础研究并没有取得实质性突破,或曰针对阿尔茨海默症的研究虽然取得了某些进展,但距离掌握阿尔茨海默症的全部致病机理还相当遥远。致病机理不清,研发药物很难全部对症,只能根据研究的进展,推出相应的药物。客观而言,现在对阿尔茨海默症的研究成果,大都出自国外大制药公司的研究室。
现在,研发和实验阿尔茨海默症新药成为各大药企的主攻方向之一。但是,即使这样,有关治疗阿尔茨海默症的新药的信息,也并不都是鼓舞人心的。去年,著名药企礼来公司透过著名医学杂志《新英格兰》郑重宣布,其投资90亿美元研发费用的阿尔茨海默症的治疗新药研究的三期临床试验失败,并发表了相关试验数据。这一病症,越来越成为一种常见病和多发病。有统计显示,2015年,全球有阿尔茨海默症患者4680万;保守估计,到2030年,阿尔茨海默症患者将达到7470万,2050年将突破1.3亿。在中国,阿尔茨海默症患者的数量在2010年就已达540万,随着老龄化社会的到来,高龄人口占比增加,患者数量增长迅速。
来源:光明网
【科普视频】阿尔兹海默症真的无药可救吗?

患上阿尔兹海默症意味着什么?

女性更易患阿尔兹海默症,竟然是因为它!
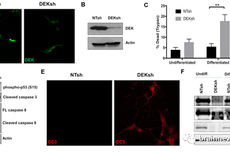
DEK表达缺失导致阿尔兹海默症

阿尔兹海默症最新研究进展一览
阿尔兹海默症有救了?世界首款阿尔茨海默症药物明年或将上市!


【科普】阿尔兹海默症
喝酒脸红跟阿尔兹海默症有什么关系?
2016药物/化学品致癌性试验研究高级培训班在青岛举行
2015年(第五届)药物毒理学年会在海口市顺利召开


