孙熙宸
加好友
孙熙宸 2019-11-05
来源:中国科学院南海海洋研究所
1805年德国化学家泽尔蒂纳从罂粟中首次分离出单体化合物吗啡,从此开创了从天然产物中寻找活性物质的先河。紧接着,科学家们从植物中分离得到麻黄碱、吐根碱、马钱子碱、长春新碱、利血平、士的宁、奎宁、咖啡因、可待因、阿托品、地高辛、青蒿素和紫杉醇等活性物质。
据文献统计,自1981年至2014年批准上市的新药中,约77%来源于小分子药物,而小分子化合物中有约65%直接或间接来源于天然产物,特别是在抗癌和抗感染方面更为突出。因此,从天然产物中挖掘具有显著生物活性的药物先导化合物,是新药开发的主要途径。
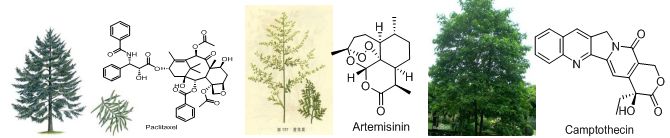
图1 紫杉醇、青蒿素和喜树碱
海洋:新功能生物活性物质的源泉
随着分离技术和色谱技术的快速发展,天然产物的发展和鉴定取得了突飞猛进的发展,同时也面临着严峻的挑战——陆地资源的日趋减少,人类需求的改变。上世纪70年代末,人们逐渐将视线转向海洋。
海洋环境独特,蕴藏着丰富的微生物资源。海洋微生物具有物种多样性、遗传多样性、代谢产物化学多样性等特点,是新颖活性次级代谢产物的重要来源。海洋微生物分布广泛,海洋动植物表面或内部组织、海水、深海沉积物、热液口和冷泉等生境都能发现其踪迹,是新功能生物活性物质的重要源泉。
海洋微生物中“皇冠”分子的发现
近期,中科院南海海洋研究所刘永宏团队从北部湾海绵共附生真菌Aspergillus sp. SCSIO 41018的发酵产物中分离鉴定出3个间苯三酚类异质二聚体gilluones A–C (1–3)。
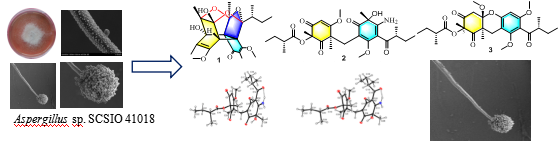
图2 Aspergillus sp. 形态学特征以及三个间苯三酚类异质二聚体gilluobes A–C
其中,gilluone A (1)为自然界较为罕见的类似“皇冠”笼状结构,由两个缩酮和一个半缩酮结构片段组成。该化合物是由乙酰辅酶A在聚酮合酶的作用下分别生成中间体间苯三酚和乙酰化的间苯三酚,两个单体化合物经过脱芳构化,Diels-Alder加成、缩环、缩酮等反应得到的。
笼状化合物在天然产物中较为罕见,河豚毒素就是笼状化合物。此外,现已报道的有二氢二苯噁庚生物碱varioxepine A、bisorbicillinoid类化合物dihydrotrichodimerol、聚酮类化合物citrofulvicin、愈创木内脂二聚体artesin A等。
而gilluones B 和C (2, 3) 为乙酰化间苯三酚异质二聚体,且gilluone B(2) 间苯三酚中的一个酮羰基发生转氨。生物活性评价显示化合物对五株人源肿瘤细胞具有不同程度的细胞毒活性,这为筛选抗肿瘤药物提供了先导化合物。综合利用X-射线单晶衍射,圆二色谱计算和化学衍生方法确定新化合物的立体绝对构型。
此次研究分离鉴定出的均为间苯三酚类化合物,此类化合物具有丰富的结构和生物活性多样性。它们多来源于金丝桃属和藤黄属等植物,较少发现于微生物的代谢产物;具有抑菌、抗抑郁和抗肿瘤等生物活性;结构复杂多变:具有二聚体、三聚体、多聚体等结构类型。该研究从微生物的次级代谢产物中发现三个间苯三酚异质二聚体,丰富了间苯三酚化合物的化学多样性。
该成果以封面文章发表在英国皇家化学学会期刊Organic Chemistry Frontiers(《有机化学前沿》)。

图3 文章封面
来源:zkyzswx 中科院之声
原文链接:http://mp.weixin.qq.com/s?__biz=MjM5NzIyNDI1Mw==&mid=2651764757&idx=2&sn=ceda1018052af224b25b266a2ee54b55&chksm=bd2752478a50db510d5182e4cddd257d3083f2ea3fb0c2beabb1c689e6facd93adc087527b88&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn