科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
本月26号,来自西班牙的研究团队在成年人的大脑中发现了大量的新生神经元,其中年龄最大的个体年龄甚至接近90岁,而在阿尔兹海默症患者的脑内,新神经元的形成明显减少,该研究可能为攻克阿尔兹海默症带来新的曙光,相关论文发表在《自然-医学》杂志上。
人类记忆杀手:阿尔兹海默症
阿尔兹海默症即Alzheimer’s disease ,简称AD。近年来,患病的年迈老人因为记不得回家的路而找民警帮忙的报道层出不穷。这种记忆力障碍就是AD患者最典型的一种症状。除此之外,AD患者也表现出认知功能障碍等神经精神症状,一旦起病,不可逆转。

图1 AD前期症状主要包括短期记忆退化、理解表达能力下降、认知障碍、性格改变和日常行为困难等。(图片来源:《健康天天帮》节目组)
世界卫生组织资料显示,全球约有4750万人患有阿尔茨海默症,**中国有近1000万确诊患者,占全球四分之一。**随着老龄化程度的增加,预计到2050年,我国的老年人口大约会增长到4亿,AD症患者将达到2000万人。
需要注意的是,由于AD患者主要为老年人,且随着年龄增长,病情逐渐加重,导致很多人认为这是一种衰老症状,而没有引起足够的重视。而事实上AD是一种疾病,如果没有有效的预防和治疗方法,家庭和社会都将会面临沉重的负担。
药物研发之路漫漫
AD作为一种起病隐匿的复杂异质性疾病,其特征性的改变主要为β淀粉样蛋白沉积形成的细胞外老年斑和神经细胞内神经原纤维缠结。除此之外,还有皮质弥漫性萎缩、脑沟回增宽、脑室扩大、神经元大量减少等病变。
尽管AD发病原因和机制目前还没有定论,科研人员和制药企业仍一直在努力研发可以缓解和治疗AD的药物,但是收效甚微。
本月21号,美国生物技术公司百健(Biogen)和日本著名药企卫材(Eisai)宣布,终止一种名为aducanumab的阿尔兹海默症药物的两项全球三期研究。aducanumab主要是针对β淀粉样蛋白沉积这种病理特征而开发的,独立的数据监测机构在对两项研究的数据进行分析后认为,该药物对AD患者的认知功能损伤没有改善作用。除此之外,著名药企罗氏也在不久前宣布终止了几项关于AD药物的临床研究,AD新药研发之路举步维艰。
另辟蹊径:寻找新生神经元

图2 健康脑的神经元(左)和患病脑的神经元(右)(图片来源:veer图库)。
AD患者大脑的一个重要特征是**神经元大量减少。**基于此特征,也有科研人员致力于通过训练或者药物刺激神经元新生来预防和治疗AD。我们都知道,人体的大部分器官都会有细胞的衰亡,也不断有新细胞的产生,比如肝脏的细胞再生能力就很强。然而关于成人大脑中是否存在新生神经元则一直存在争议。
在早期的大脑研究中,在显微镜下,成年人的大脑中观察不到存在正在分裂的神经元。因此很长一段时间,大家认为神经元不会再生。最近二三十年随着新的实验技术的发展,比如利用新的放射性元素标记和核苷酸类似物标记技术,不同国家的科学家陆续报道,在成人的大脑中发现了新生神经元。然而,真正在成年个体大脑中观察到新生神经元的研究主要来自于啮齿类动物,来源于成人大脑的直接证据几乎没有,因此还不足以下定论。
成年人大脑中的新生神经元之谜
就在科研人员迫切地想要在成年人的大脑中找到新生神经元存在的证据时,2018年两篇关于新生神经元的研究让这个问题更加迷雾重重。**来自美国的两个研究团队采用类似的方法,却得到相反的结果。**其中一项研究发表在《自然》杂志,它来自美国加州大学旧金山分校的索雷尔斯(S. F. Sorrells)团队1,另一项发表在《细胞-干细胞》杂志的研究则来自美国哥伦比亚大学的博尔德里尼(M. Boldrini)团队2。
两项研究都采用人的尸体大脑为研究对象,采用免疫荧光染色来标记一种双皮质素(doublecortin,DCX)的蛋白,这种蛋白主要在分裂中的神经元和早期分裂后的子代神经中表达。
索雷尔斯团队研究了59个年龄跨度从孕期14周的胎儿到 77岁生前健康的老年人的尸体大脑标本,而博尔德里尼团队的研究样本是28个生前健康个体的尸体大脑标本,年龄在14岁到79岁之间。前者在胎儿和婴儿的大脑中发现了大量的神经元母细胞和新生的神经元,但在所有成年个体的脑标本中没有一例观察到新生的神经元。而后者则发现,即使是老年人,死亡时海马仍然有数以千计的新生神经元。
成年人的大脑中究竟有没有新生神经元呢?答案似乎更加扑朔迷离。

图3 神经元(图片来源:veer图库)
尘埃落定?最新研究揭开新生神经元神秘面纱
令人振奋的是,距离前两篇报道过去才一年,今天发表在《自然-医学》杂志的一项研究给大家打了一剂强心针。来自西班牙的伦斯马丁(M.L. Martin)团队在生前健康的成年人尸体大脑以及AD患者大脑中均发现了大量的新生神经元,其中年龄最大的个体年龄甚至接近90岁。那么伦斯马丁的研究是否更加可信呢?
在详细解读这篇文章之前,我们首先来认识一下大脑中一个与记忆和神经元新生有关的脑区,即海马。该脑区因形似海马,故得名。海马包含有四个亚区,即CA1、CA2、CA3和齿状回(dentate,DG)(图4)。
海马主要负责学习和记忆。除此之外,**在成年哺乳动物的大脑中,海马还具有另一个与众不同又很重要的特征,它可以为大脑提供新的神经元,**这个过程也被称为“成年海马神经形成(adult hippocampal neurogenesis,AHN)”。目前发现的新生神经元主要来自于DG区。对大量的AD患者大脑的研究表明,海马DG区的神经形成显著改变。
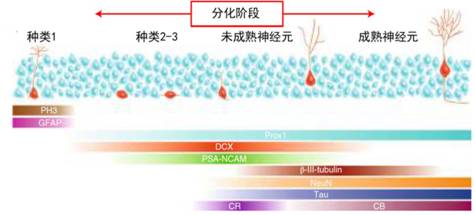
图4 大鼠脑中海马的主要结构。左边为冠状面,右边为矢状面。图片来源:George Paxinos & Charles Watson,《The Rat Brain》(《大鼠脑立体定位图谱》第六版)
由于前人的研究报道很不一致,而且人的大脑标本十分难得,研究人员在标本预处理时慎之又慎。
首先,他们排除了医疗记录中显示有过神经系统疾病或者认知障碍的个体的大脑,并且确认了这些个体的大脑处于布拉克(Braak)分期的0阶段,即大脑没有病理改变。Braak分期来源于德国的神经病理学家Heiko Braak,Braak主要研究帕金森病(Parkinson's disease,PD)的发病机理,经过大量的标本研究,发现在PD患者的大脑损伤主要可以分为6期,从1期到6期,大脑的病理损伤越来越严重,患者的症状也越来越严重。后来Braak分期也被用来评估AD患者的病程发展。
此外,研究人员严格监测了大脑从死亡到组织固定的时间间隔,确保最优化的固定时间和条件。同时避免冷冻、石蜡包埋以及其他可能对大脑组织产生损伤的机械操作,最终获得了13个年龄从43岁到87岁的个体的大脑。通过DCX染色,研究人员欣喜地在DG鉴定出了数以千计的表达DCX蛋白的神经元,而在非神经源性的脑区则没有检测到DCX的信号。
形势似乎一片大好,但是研究人员还要找到更加可靠的证据。思路其实很简单,如果成年人的大脑中存在新生神经元,由于不同细胞分裂的时间点不一样,在固定标本时,分裂后的神经元应该处于不同的成熟阶段。所以**如果可以在表达DCX蛋白的神经元中再鉴定出处于不同成熟阶段的细胞亚群,就能证明成人大脑中确实有新生神经元的产生。**那么如何鉴定呢?
实际上,细胞分裂之后,在AHN的不同成熟阶段,会表达不同的细胞标记物(图5),比如未成熟的神经元中会表达神经细胞粘附分子和钙网膜蛋白(CR),而在分化程度更高的神经元中,则会表达钙结合蛋白(CB)。除此之外,还有一些其他标记物,通过检测这些标记物的表达,就可以判断神经元位于哪个成熟阶段。
不出所料,研究人员成功地在表达DCX蛋白的神经元中检测到了各种标记物。大量的神经元表达DCX蛋白,同时他们还表达代表不同成熟阶段的标记物,表明在成人大脑中,确实存在大量的新生神经元。
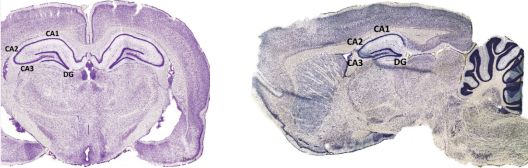
图5 成年海马神经形成过程中,细胞成熟时不同标记物的表达阶段模型。(图片来源:翻译自参考文献3)
AD****患者大脑的新生神经元数量显著降低
为了进一步探究在AD患者大脑中是否也存在新生神经元。伦斯马丁团队检测了45个年龄位于52岁到97岁的AD患者的大脑,这些患者的病程不同,涵盖了6个Braak分期。
结果发现随着年龄的增长,表达DCX蛋白的神经元的数量越来越少。而且与同龄的健康人相比,AD患者大脑中表达DCX蛋白的神经元的数量显著降低(图6)。这表明,除了年龄引起的新生神经元的数量降低,还有其他因素导致AD患者大脑中的新生神经元减少。通过检测处于不同Braak分期的大脑中表达DCX蛋白的神经元中各种细胞标记物的表达水平,发现首先在Braak三期的患者中存在神经细胞粘附分子表达的降低。随着病程发展,其他标记物的表达也逐渐降低。

图6 双皮质素阳性细胞数量和年龄的关系。图中白色圆圈和红色圆圈分别代表健康个体和处于不同病程阶段的AD患者的大脑中表达双皮质素的细胞的数量。可以看到,随着年龄增加,表达双皮质素的细胞的数量慢慢减少,并且AD患者中表达双皮质素的细胞的数量明显低于相近年龄的健康个体中表达双皮质素的细胞数量。(图片来源:翻译自参考文献3)
预防和治疗AD的新希望
伦斯马丁团队的研究强有力地证明了**不管是在健康成年人的大脑中还是AD患者的大脑中,均存在新生神经元,但是AD患者的新生神经元显著减少。**如果能够通过一些非侵入性的手段检测AHN的受损程度,也许可以作为检测AD病情发展的重要方法。
该研究也为那些致力于通过促进神经元新生来治疗包括AD在内的脑部疾病的探索带来了一丝曙光。希望在不久的将来,可以听到治疗AD新药的好消息。
参考文献:
S. F. Sorrells, M. F. Paredes, A. Cebrian-Silla, K. Sandoval, D. Qi, K. W. Kelley, D. James, S. Mayer, J. Chang, K. I. Auguste, E. F. Chang, A. J. Gutierrez, A. R. Kriegstein, G. W. Mathern, M. C. Oldham, E. J. Huang, J. M. Garcia-Verdugo, Z. Yang, A. Alvarez-Buylla, Human hippocampal neurogenesis drops sharply in children to undetectable levels in adults. Nature 555, 377–381 (2018).
M. Boldrini, C. A. Fulmore, A. N. Tartt, L. R. Simeon, I. Pavlova, V. Poposka, G. B. Rosoklija, A. Stankov, V. Arango, A. J. Dwork, R. Hen, J. J. Mann, Human hippocampal neurogenesis persists throughout aging. Cell Stem Cell 22, 589–599.e5 (2018).
E.P.M. Jimenez, M.F. Garcia, J.T. Roncal, A. Rabano, F. Cafini, N.P. Bazarra, J.Avila, M.L. Martin, Adult hippocampal neurogenesis is abundant inneurologically healthy subjects and drops sharplyin patients with Alzheimer’s disease. Nature Medicine, (2019).