科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
在晶体学中,金刚石结构又称为金刚石立方晶体结构(diamond cubic lattice structure),原型是金刚石。金刚石结构中的每个原子与相邻的4个原子形成正四面体。具有金刚石结构的晶体除了金刚石以外,还有硅、锗、α-锡等。
结构金刚石结构的原型是金刚石晶体,又称钻石。在金刚石晶体中,每个碳原子都以SP3杂化轨道与另外4个碳原子形成共价键,构成正四面体。由于金刚石中的C-C键很强,所以金刚石硬度大,熔点极高;又因为所有的价电子都被限制在共价键区域,没有自由电子,所以金刚石不导电1。
金刚石结构2是一种由两个面心立方点阵沿立方晶胞的体对角线偏移1/4单位嵌套而成的晶体结构,属于面心立方布喇菲点阵(Bravais lattice), 立方晶系,Fd-3m (227号)空间群。如果立方晶胞的晶格常数是a, 则金刚石结构的原胞的基矢是
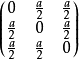 每个原胞含有两个原子,在原胞中的坐标分别是
每个原胞含有两个原子,在原胞中的坐标分别是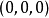 和
和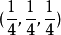 . 金刚石结构的每个结晶学原胞(即晶胞)含有8个原子,在晶胞中的坐标分别是
. 金刚石结构的每个结晶学原胞(即晶胞)含有8个原子,在晶胞中的坐标分别是
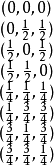
性质金刚石结构的原型是金刚石的晶体结构。在金刚石晶体中,每个碳原子的4个价电子以sp3杂化的方式,形成4个完全等同的原子轨道,与最相邻的4个碳原子形成共价键。这4个共价键之间的角度都相等,约为109.28度,精确值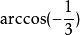 ,这样形成由5个碳原子构成的正四面体结构单元,其中4个碳原子位于正四面体的顶点,1个碳原子位于正四面体的中心。因为共价键难以变形,C-C键能大,所以金刚石硬度和熔点都很高,化学稳定性好。共价键中的电子被束缚在化学键中不能参与导电,所以金刚石是绝缘体,不导电。
,这样形成由5个碳原子构成的正四面体结构单元,其中4个碳原子位于正四面体的顶点,1个碳原子位于正四面体的中心。因为共价键难以变形,C-C键能大,所以金刚石硬度和熔点都很高,化学稳定性好。共价键中的电子被束缚在化学键中不能参与导电,所以金刚石是绝缘体,不导电。
金刚石结构的空间堆积率(又称占位比,为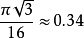 )比面心立方结构(
)比面心立方结构(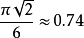 )和六角密积结构(与长轴短轴比有关,近似与面心立方结构相同)低,也比体心立方结构(
)和六角密积结构(与长轴短轴比有关,近似与面心立方结构相同)低,也比体心立方结构(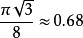 )低。但金刚石结构的原子密度(即单位空间中的原子数)大。这一特点对于金刚石尤其显著,因为金刚石中的C-C键长很小1。
)低。但金刚石结构的原子密度(即单位空间中的原子数)大。这一特点对于金刚石尤其显著,因为金刚石中的C-C键长很小1。
结构辨析金刚石结构与闪锌矿结构(zincblende structure)非常相似,不同之处在于,构成闪锌矿结构的两个面心立方点阵上的原子是不同种类的,例如Zn和S, 而构成金刚石结构的原子是同种类的。闪锌矿结构的堆积率随两种原子的相对大小而变。
金刚石与石墨同样由碳原子构成,是同素异形体。由于碳原子的结合方式不同,两种物质的性质迥异。石墨中的碳原子是按sp2杂化的方式形成共价键的,在一个平面上以共价键结合成蜂窝状结构,层与层间靠比较弱的范德华力结合。同一层内碳原子之间的结合比金刚石还强,所以石墨的熔点比金刚石更高。但层间结合较弱,很容易发生滑移,所以硬度很低。石墨中碳原子的4个价电子中的3个形成共价键,另外一个价电子在晶体中形成大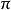 键,可以沿石墨层导电。
键,可以沿石墨层导电。
金刚石与其他的碳同素异型体之间的差别也是有碳原子结合方式的不同而引起的3。
人造金刚石金刚石俗称“金刚钻”,也就是我们常说的钻石,它是一种由纯碳组成的矿物,也是自然界中最坚硬的物质。自18世纪证实了金刚石是由纯碳组成的以后,人们就开始了对人造金刚石的研究,只是在20世纪50年代通过高压研究和高压实验技术的进展,才获得真正的成功和迅速的发展,人造金刚石亦被广泛应用于各种工业,工艺行业4。
本词条内容贡献者为:
石季英 - 副教授 - 天津大学