科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2019-11-08
来源:中国高科技
直接在临床分离的多重耐药菌中进行功能基因组学研究是解析耐药机制以及开发抗耐药策略最直接有效的方法。然而,由于缺乏能在基因型各异的临床耐药菌中直接进行高效基因编辑的工具,目前这方面的研究大部分仍然止步于多组学分析加以在模式菌中的异源验证。这种脱离了临床耐药菌本身遗传背景的研究策略,往往忽略了遗传背景本身对耐药因子的影响以及不同耐药因子之间的相互关系,很多时候无法对临床抗耐药研发提供真正有效的依据。开发一种能与临床菌复杂各异的基因型兼容、并且简便高效的基因组编辑方法将有助于我们打破这一研究壁垒。
2019年11月5日,香港大学闫爱新团队和中科院微生物所向华团队联合在Cell Reports上发表了题为“Native CRISPR-Cas-Mediated Genome Editing Enables Dissecting and Sensitizing Clinical Multidrug-Resistant P. aeruginosa” 的文章。作者以多重耐药研究中最重要的标准参照病原菌铜绿假单胞菌作为研究对象,报道了在临床多重耐药铜绿假单胞菌中开发基于内源性I-F型 CRISPR的、高效简便的基因编辑系统,并在该系统的辅助下,实现了在临床多重耐药菌株自身遗传背景下耐药机制的原位解析和抗耐药化合物的筛选。

铜绿假单胞菌是当前亟需关注的七种病原细菌“ESKAPE”(肠球菌属,金黄色葡萄球菌,克雷伯菌,鲍曼不动杆菌,铜绿假单胞菌和肠杆菌属)之一。由于该病原菌极易产生多重耐药性,现有的抗生素疗法不仅不能有效地根治其感染,阻止耐药性的传播,还会破坏宿主的益生菌群,对人体健康产生极大的副作用。早先,闫爱新团队对2015-2016年香港玛丽医院各种感染性疾病包括伤口、尿道、耳部、脓液、引流液及血液感染的患者中分离的铜绿假单胞菌进行了耐药检测并报道了一株有潜在流行性特征的多重耐药菌PA154197【1】。然而,研究人员尝试了传统的双交换同源重组策略【2】和基于外源Cas9的双载体编辑系统【3】均未能实现对该菌株基因组的编辑,这严重阻碍了对其耐药性机制的深入解析。全基因组测序结果显示PA154197含有1个完整的内源性I-F型CRISPR-Cas系统。
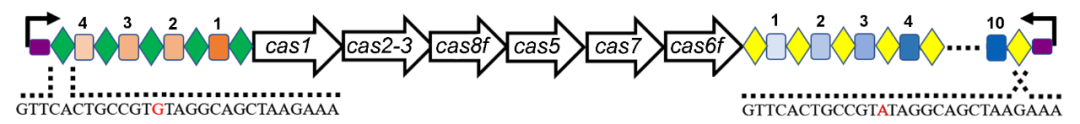
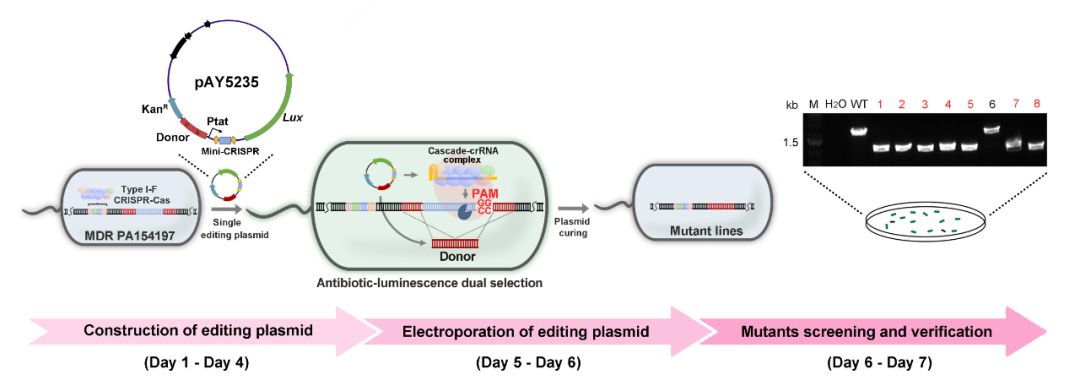
他们通过与中科院微生物所向华研究团队合作,基于该系统共同开发出了一套具有抗性基因和报告基因双筛选标记的单质粒基因编辑系统。该系统包含一个由强启动子(Ptat)驱动的mini-CRISPR元件(用于表达crRNA)和luminescence报告基因(luxCDABE)(用于辅助阳性克隆筛选),并同时含有同源重组的donor片段和用于克隆筛选的卡那霉素抗性基因。通过电转法将该质粒转入PA154197后,研究人员通过对具有明显荧光信号的转化子进行进一步PCR及测序验证,能够快速(一周以内)获得阳性克隆,并同时实现了对其基因组高效、多样化的精准编辑(包括基因敲除,DNA插入和定点突变等)。值得一提的是,基于荧光信号的阳性克隆初筛策略巧妙地规避了耐药菌在抗生素筛选下假阳性率高的难题,大大降低了克隆筛选的工作量。进一步的研究表明这一系统也适用于其它含有I-F型CRISPR的环境和临床铜绿假单胞菌株,如分离自北太平洋的Ocean-100和另一株临床菌株PA150567。
基于这套高效的基因编辑系统和前期的基因组与转录组分析,研究人员构建了一系列突变菌株并揭示了PA154197中三个关键的耐药突变 (mexR:T226G; mexT:8bp 缺失;gyrA:T248C)以及它们之间显著的协同关系。随后利用这一系列突变菌株对多种抗菌化合物进行了耐药性检测,研究人员发现该耐药菌对阳离子拟肽类小分子(Small Cationic Peptidomimetics)与多种抗生素表现出显著的负相关的伴随性敏感现象(Collateral Sensitivity),并且该伴随性敏感现象主要依赖于其中的一个耐药突变(mexT)。最后研究人员证明了阳离子拟态类小分子通过作用于耐药菌的外膜从而能够显著提高该耐药菌对抗生素的敏感性,以及阳离子拟态类小分子与抗生素的联用能够有效地抑制耐药菌的生长并对耐药菌有特异高效的杀灭效果。
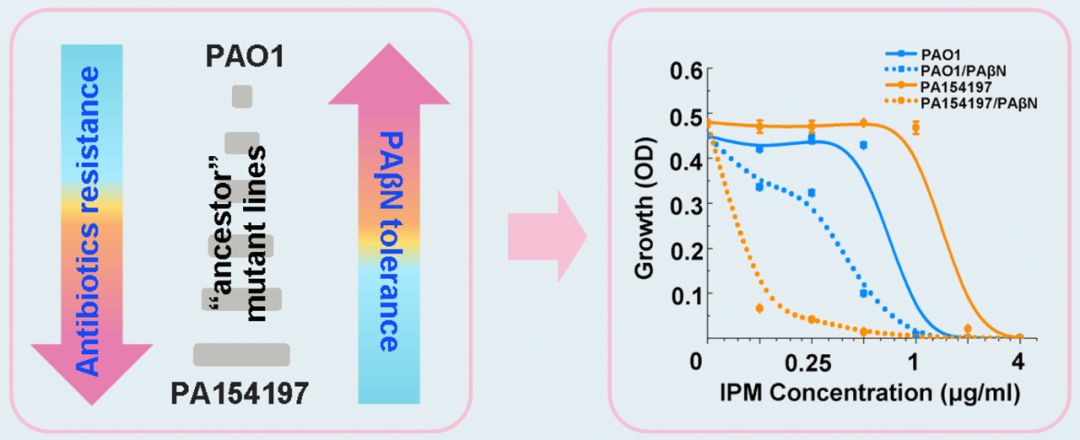
该研究首次利用内源性I-F型CRISPR系统实现了对多重耐药菌的基因编辑,由于I-F型CRISPR系统普遍存在于多重耐药的铜绿假单胞菌中(70%)【4】,这将为临床耐药菌的研究提供高效、简便的基因编辑方法和一种原位耐药性解析的新策略。此外,该研究对临床多重耐药菌的耐药机理进行了解析并发现了该菌对阳离子拟态类小分子的伴随性敏感现象。这一新发现将为解决临床抗耐药应用提供新的思路和手段。
徐泽凌博士和李明副研究员为该文章共同第一作者,香港大学闫爱新副教授和中科院微生物所向华研究员为共同通讯作者。
原文链接:
https://doi.org/10.1016/j.celrep.2019.10.006
参考文献
1. Cao, H., Xia, T., Li, Y., Xu, Z., Bougouffa, S., Lo,Y.K., Bajic, V.B., Luo, H., Woo, P.C.Y., and Yan, A. (2019). Uncoupled quorumsensing modulates the interplay of virulence and resistance in amultidrug-resistant clinical Pseudomonas aeruginosa isolate belonging tothe MLST550 clonal complex. Antimicrob Agents Chemother. 63,e01944-18
2. Choi, K.H., and Schweizer, H.P. (2005). An improvedmethod for rapid generation of unmarked Pseudomonas aeruginosa deletionmutants. BMC Microbiol. 5, 30.
3. Chen, W., Zhang, Y., Zhang, Y., Pi, Y., Gu, T., Song,L., Wang, Y., and Ji, Q. (2018). CRISPR/Cas9-based genome editing in Pseudomonasaeruginosa and cytidine deaminase-mediated base editing in Pseudomonasspecies. iScience. 6, 222-231.
4. van Belkum, A., Soriaga, L.B., LaFave, M.C., Akella, S.,Veyrieras, J.B., Barbu, E.M., Shortridge, D., Blanc, B., Hannum, G., andZambardi, G. (2015). Phylogenetic distribution of CRISPR-Cas systems inantibiotic-resistant Pseudomonas aeruginosa. MBio. 6,e0179615.
来源:cas-hitech 中国高科技
原文链接:http://mp.weixin.qq.com/s?__biz=MzA3MDczMTAzMA==&mid=2650047671&idx=2&sn=119449914b9989e2c04fe9092909044f&chksm=873870ceb04ff9d8f4fdfe62328cda3a1f59d0291faa793c55b9fc524bffed6706a8e23f6026&scene=27#wechat_redirect
版权声明:除非特别注明,本站所载内容来源于互联网、微信公众号等公开渠道,不代表本站观点,仅供参考、交流、公益传播之目的。转载的稿件版权归原作者或机构所有,如有侵权,请联系删除。
电话:(010)86409582
邮箱:kejie@scimall.org.cn

假单胞菌可通过释放毒素保护植物免遭病害

抗生素再上热搜,这些炎症不用抗生素!
抗生素中的明星分子
美科学家发现新抗生素,能杀死多重耐药菌
为什么不能滥用抗生素?

让抗生素精准狙击细菌

中国科学家培育出基因编辑瘦肉猪:脂肪少24%

治疗肺部感染的首个活体药物创建 针对铜绿假单胞菌

滥用抗生素的最大危害
抗生素的危机:细菌可从竞争对手那里获得耐药性