科技工作者之家
科技工作者之家APP是专注科技人才,知识分享与人才交流的服务平台。
科技工作者之家 2020-11-17
黑姆荷兹自由能是Helmholtz free energy英文的音译,也译为亥姆霍兹自由能(在物理学中也常直接简称为自由能),是一个重要的热力学参数,常用F或A表示,它的定义是:F=U-TS,其中U是系统的内能,T是温度,S是熵。1
简介自由能可以被理解成是系统内能的一部分,这部分在可逆等温过程中被转化成功。在粒子数不变的等温过程中,系统对外界所做的功一定只能小于或者等于其自由能的减少,也就是说,系统自由能的减少就是等温过程中系统对外界所做的最大功。2
表示方法自由能常用F或A表示,其被定义为:
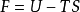
其中U是系统的内能,T是温度,S是熵。3
自由能的微分形式是:
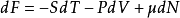
其中P是压强,V是体积,μ是化学势。3
主要应用某过程的自发状态及平衡条件的判断
用熵增原理来判别一个过程的自发方向及平衡条件时,系统必须是隔离的,否则必须考虑环境的熵变。亦就是说,对非隔离系统,要判断一个过程是否能够进行,应该把系统和环境的总体看成一个新的隔离系统,并把系统的熵变和环境的熵变的总和计算出来,才能得到普遍性的熵判据。因为,通常反应总是在等温、等温等压或等温等容条件下的封闭系统内进行的,这时利用熵判据来判别过程的方向时,除了考虑系统的熵变,还得考虑环境的熵变,很不方便。为此亥姆霍兹(VonHelmholz H L P,1821~1984,德国人)和吉布斯(GibbsJ W,1839~1903,美国人)又定义了两个状态函数—亥姆霍兹自由能和吉布斯自由能。用这两个辅助函数的变化值作判据,只考虑系统自身性质的变化便可达到目的,再无需考虑环境的影响了。4
本词条内容贡献者为:
胡建平 - 副教授 - 西北工业大学